题目内容
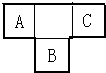 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.(1)写出A、B、二种元素的名称
(2)B元素位于元素周期表中第
(3)C的原子结构示意图为
(4)由元素A、C及氢元素形成的化合物中含有的化学键的类型有
分析:A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,据此解答.
解答:解:A、B、C为短周期元素,由元素所处位置可知,A、C处于第二周期,B处于第三周期,设B元素的质子数为x,则A的核外电子数为x-9,C的核外电子数为x-7,可得x-9+x-7=x,解之得x=16,所以A的质子数为7,B的质子数为16,C的质子数为9,则A、B、C分别为N、S、F元素,
(1)由上述分析可知,A为氮、B为硫,故答案为:氮;硫;
(2)B元素的原子核内质子数为16,原子核外有3个电子层,最外层电子数为6,位于元素周期表第三周期ⅥA族,故答案为:三;ⅥA;
(3)C的原子序数为9,原子核外有2个电子层,最外层电子数为7,原子结构示意图为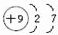 ,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为:
,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为: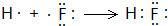 ,
,
的过程:
故答案为: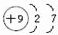 ;
;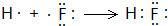 ;
;
(4)由元素N、F及氢元素形成的化合物为NH4F,含有离子键、共价键,
故答案为:离子键、共价键.
(1)由上述分析可知,A为氮、B为硫,故答案为:氮;硫;
(2)B元素的原子核内质子数为16,原子核外有3个电子层,最外层电子数为6,位于元素周期表第三周期ⅥA族,故答案为:三;ⅥA;
(3)C的原子序数为9,原子核外有2个电子层,最外层电子数为7,原子结构示意图为
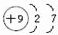 ,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为:
,F2与H2反应生成HF,HF属于共价化合物,原子之间形成1对共用电子对,用电子式表示形成过程为: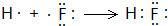 ,
,的过程:
故答案为:
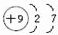 ;
;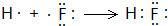 ;
;(4)由元素N、F及氢元素形成的化合物为NH4F,含有离子键、共价键,
故答案为:离子键、共价键.
点评:本题考查位置结构性质关系的综合应用,难度不大,根据同主族元素原子序数关系推断元素是关键,熟练掌握元素周期表的结构.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
|
A、B、C为短周期元素,它们在周期表中的位置如下图所示.已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
| |
A. |
Be Na Al |
B. |
B Mg Si |
C. |
C Al P |
D. |
O P Cl |
A、B、C为短周期元素,它们在周期表中的位置如下图所示。已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
|
|
A |
|
|
B |
|
C |
A.Be Na Al B.B Mg Si C.C Al P D.O P Cl
A、B、C为短周期元素,它们在周期表中的位置如下图所示。已知B、C两元素所在周期表中族数之和是A元素族数的2倍,B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
| A | ||
| B | C |
- A.Be Na Al
- B.B Mg Si
- C.C Al P
- D.O P Cl

