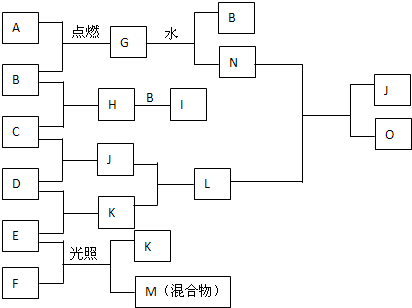
题目内容
常温常压下CH4、H2、CO的混合气体30ml,恰好和同况下30ml O2完全反应,则其中含CH4
10
10
ml;当H2为10ml时,上述混合气体完全燃烧恢复至原状态后生成气体体积为20
20
ml.分析:燃烧发生反应:2CO+O2=2CO2、2H2+O2=2H2O、CH4+2O2=CO2+2H2O,令甲烷的体积为x mL,则CO、氢气的总体积为(30-x)mL,根据方程式计算消耗氧气的体积,据此列方程计算;
当H2为10ml时,上述混合气体完全燃烧恢复至原状态后,水液体,生成气体为二氧化碳,根据碳元素守恒计算生成二氧化碳的体积.
当H2为10ml时,上述混合气体完全燃烧恢复至原状态后,水液体,生成气体为二氧化碳,根据碳元素守恒计算生成二氧化碳的体积.
解答:解:令甲烷的体积为x mL,则CO、氢气的总体积为(30-x)mL,故:
CH4+2O2=CO2+2H2O,
xmL 2xmL
由2CO+O2=2CO2、2H2+O2=2H2O可知,2体积CO与2体积氢气都消耗1体积氧等,故CO与氢气共消耗氧气为
×(30-x)mL=(15-0.5x)mL,
所以,2x+(15-0.5x)=30,解得x=10,
当H2为10ml时,则CH4、CO的总体积为20mL-10mL=20mL,混合气体完全燃烧恢复至原状态后,水液体,生成气体为二氧化碳,
根据碳元素守恒可知,V(CO2)=V(CH4+CO)=20mL,
故答案为:10;20.
CH4+2O2=CO2+2H2O,
xmL 2xmL
由2CO+O2=2CO2、2H2+O2=2H2O可知,2体积CO与2体积氢气都消耗1体积氧等,故CO与氢气共消耗氧气为
| 1 |
| 2 |
所以,2x+(15-0.5x)=30,解得x=10,
当H2为10ml时,则CH4、CO的总体积为20mL-10mL=20mL,混合气体完全燃烧恢复至原状态后,水液体,生成气体为二氧化碳,
根据碳元素守恒可知,V(CO2)=V(CH4+CO)=20mL,
故答案为:10;20.
点评:本题考查混合物的有关计算,难度不大,关键是根据方程式判断等体积的CO与氢气消耗氧气的体积相等,注意守恒思想的运用.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 HCO3-+H+的平衡常数K1=
HCO3-+H+的平衡常数K1= CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O H2CO3+OH-,
H2CO3+OH-,