题目内容
下列实验操作、目的、结论正确的是( )
A.浓H2SO4与乙醇的混合液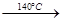 制乙烯气体
制乙烯气体
B.试液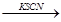 颜色无明显变化
颜色无明显变化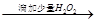 溶液变为血红色,证明试液中含Fe2+
溶液变为血红色,证明试液中含Fe2+
C.稀HNO3溶液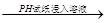 对照比色卡,pH为0.5
对照比色卡,pH为0.5
D.乙酸乙酯与乙酸的混合物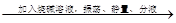 弃去上层,除去杂质乙酸
弃去上层,除去杂质乙酸
【答案】
B
【解析】
试题分析:浓H2SO4与乙醇的混合液在140 ℃时反应生成的是乙醚而不是乙烯。用pH试纸测溶液的酸碱性时,试纸不能浸入溶液以免扩散使测定结果不准。乙酸乙酯中的乙酸杂质不能用烧碱中和除去。因在烧碱溶液的存在下乙酸乙酯能水解减少了乙酸乙酯的量。故A、C、D错误。因Fe2+与KSCN不反应,被H2O2氧化为Fe3+后与KSCN溶液反应变为血红色,故B正确,答案选B。
考点:考查常见的基本实验操作
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
 ( )
( )