题目内容
以下是有关SO2、Cl2的性质实验.
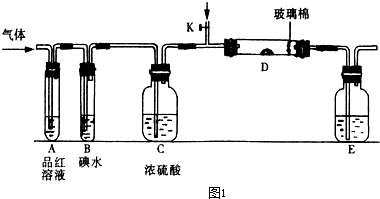
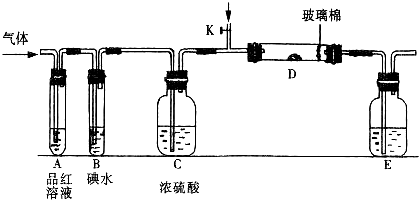
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
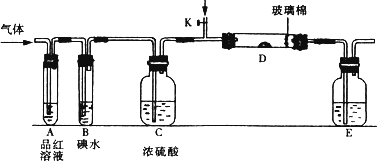
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________.
(2)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
(3)将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应,在一定温度下,反应达到平衡,得到0.12 mol SO3.则反应的平衡常数K=________.若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度________.(填“填大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”).
解析:
(1)
相同(2分) 2SO2+O2(2)4Cl2+S2O32-+5H2O
(3)K=23
.8 mol-1L(2分) 减小(2分) 降低 (2分)
 名校课堂系列答案
名校课堂系列答案以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙溶液 |
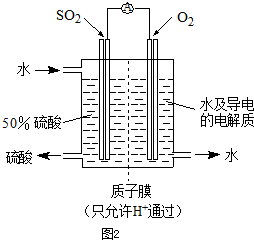
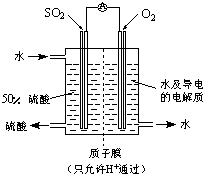
(4)某科研单位利用电化学原理用SO2来制备硫酸,装置如右图,含有某种催化剂,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
通入SO2的电极为_________极,其电极反应式为:
。
电池的总反应式为:
。