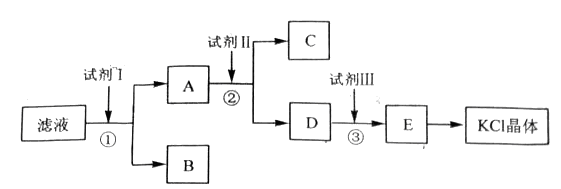
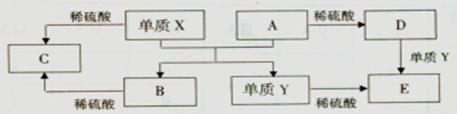
题目内容
已知,A为空气中含量最多的单质。根据下图转化关系,回答下列问题: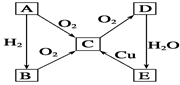
(1)写出下列物质的化学式:
A 、D 。
(2)E→C的反应方程式为 。
(3)久置的E的浓溶液常常呈黄色,原因是 。
(4)实验室制取B的化学方程式为____________________________________。
(5)现有1.00mol·L-1的E溶液,从中取出10.00 mL。此10.00 mL溶液的物质的量浓度为 mol·L-1。将前面取出的E溶液配制成0.100mol·L-1的稀溶液,所需的玻璃仪器除烧杯、玻璃棒外,还需 和 。在配制过程中定容时俯视,则所配溶液浓度 (填“偏大”或“偏小”或“无影响”)。
(1)N2 NO2(每空1分,共2分)
(2)3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O(2分)
(3)硝酸分解产生NO2溶解在硝酸中(2分)
(4)2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3↑+ 2H2O(2分)
(5)1.00 100毫升容量瓶 胶头滴管 偏大(每空1分,共4分)
解析试题分析:分析:当A为空气中含量最高的单质气体时,应为N2,则C为NO,B为NH3,D为NO2,E为HNO3;(1)写出下列物质的化学式:A、N2;NO2;答案:N2 NO2;(2)E→C的反应方程式为3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O,答案:3Cu + 8HNO3 = 3Cu(NO)3 + 2NO↑+ 4H2O;(3)E为HNO3,久置的E的浓溶液常常呈黄色,原因是硝酸分解产生NO2溶解在硝酸中,答案:硝酸分解产生NO2溶解在硝酸中;(4)B为NH3,实验室制取B的化学方程式为2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O,答案:2NH4Cl + Ca(OH)2
CaCl2 + 2NH3↑+ 2H2O,答案:2NH4Cl + Ca(OH)2  CaCl2 + 2NH3↑+ 2H2O;
CaCl2 + 2NH3↑+ 2H2O;
⑸溶液有均一性和稳定性,E为HNO3,1.00mol·L-1的E溶液,从中取出10.00 mL。此10.00 mL溶液的物质的量浓度为 1.00mol·L-1,将前面取出的E溶液配制成0.100mol·L-1的稀溶液,所需的玻璃仪器除烧杯、玻璃棒外,还需100毫升容量瓶和胶头滴管,在配制过程中定容时俯视,定容体积偏小,则所配溶液浓度偏大。 答案:1.00 100毫升容量瓶 胶头滴管 偏大
考点:无机推断,溶液的配制

 阅读快车系列答案
阅读快车系列答案利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下: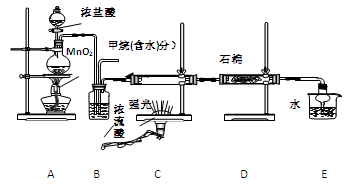
(1) B装置有三种功能:①控制气流速度;②均匀混合气体;③
|
(4) 在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(5) E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为 。
A.分液法 B.蒸馏法 C.萃取分液法 D.结晶法
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为 (填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |  | FeCl2 | FeC13 | Fe | CuCl2 |
| ② | Mg | MgO | MgCl2 | Mg(OH)2 | |
| ③ | NaOH | Na2CO3 | NaHCO3 | NaCl | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.②④ C.①③④ D.①②③
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如图转化关系(其它产物已略去),下列说法不正确的是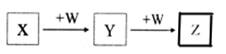
| A.若W是单质铁,则Z溶液可能是FeCl2溶液 |
| B.若W是氢氧化钠,则X与Z可反应生成Y |
| C.若X是碳酸钠,则W可能是盐酸 |
| D.若W为氧气,则Z与水作用(或溶于水)一定生成一种强酸 |