题目内容
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
① 取50.0mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
② 另取50.0mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
③ 再取50.0mL混合溶液,向其中加入20.0 mL稀硝酸,得到一种无色气体,其体积换算成标准状况时为0.448 L ;
请根据以上实验中得到的数据分析计算:
⑴ 原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
⑵ 所得混合溶液中c(Cu2+)的取值范围;
⑶ 若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉
或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
⑴ 原FeCl3溶液中c(FeCl3)=![]()
⑵50.0mL混合溶液中n (Cu2+)的取值范围为:[0.600 mol/L,1.50 mol/L]
⑶ 还可测出50.0mL混合溶液中n (Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。
解析:
⑴ 解:由I得50.0mL混合溶液中c(Cl-)=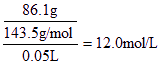
所以原FeCl3溶液中c(FeCl3)=![]()
⑵ 解:Ⅱ中加入1.4gFe无固体剩余,即发生的反应为:Fe+2Fe3+=3Fe2+
所以50.0mL混合溶液中至少含有Fe3+:![]()
Ⅲ中加入20.0mL稀硝酸后产生的气体为NO,反生的反应为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
即50.0mL混合溶液中至少含有Fe2+:![]()
50.0mL混合溶液中根据铁元素守恒有:
n (Fe2+) + n (Fe3+) = 4.0 mol/L×0.05L= 0.20 mol
根据电荷守恒有:3n (Fe3+)+2n (Fe2+)+2n (Cu2+)=n (Cl-)=![]()
当n (Fe3+) 有最小值时,n (Fe2+)、n (Cu2+)有最大值,且由上述两等式可求得
n (Cu2+)的最大值为0.075 mol
当n (Fe2+)有最小值时,n (Fe3+) 有最大值,n (Cu2+)有最小值,同样可求得
n (Cu2+)的最小值为0.03 mol
所以,50.0mL混合溶液中n (Cu2+)的取值范围为:[0.600 mol/L,1.50 mol/L]
⑶ 解:还可测出50.0mL混合溶液中n (Fe2+)的值,应进行的实验是向50.0mL混合溶液中加入足量的稀硝酸,测出生成的气体体积(标准状况)。

 阅读快车系列答案
阅读快车系列答案