题目内容
列各组离子因发生氧化还原反应而不能大量共存的是
| A.H+、Fe2+、MnO4-、SO42- | B.Ca2+、H+、SO42-、HCO3- |
| C.Na+、Cu2+、Cl-、OH- | D.Fe3+、K+、SCN-、Cl- |
A
解析试题分析:A、高锰酸具有强氧化性,能把亚铁离子氧化,不能大量共存,A正确;B、H+与HCO3-发生复分解反应生成CO2和水而不能大量共存,B不正确;C、Cu2+与OH-发生复分解反应生成氢氧化铜沉淀而不能大量共存,C不正确;D、Fe3+与SCN-发生络合反应生成Fe(SCN)3而不能大量共存,D不正确,答案选A。
考点:考查离子共存的正误判断

练习册系列答案
相关题目
下列离子方程式书写正确的是
| A.石灰石与盐酸反应 CO32-+2H+=CO2↑+H2O |
| B.硫酸和氯化钡溶液反应 Ba2++SO42-=BaSO4↓ |
| C.氢氧化铜和硫酸反应 OH-+H+=H2O |
| D.铁钉放入硫酸铜溶液中 2Fe+3Cu2+=2Fe3++3Cu |
下列离子方程式中正确的是( )
| A.向溶液Na2FeO4中加入稀H2SO4产生氧气:4FeO42-+2OH-=4Fe2++3O2↑+10H2O |
| B.向溶液NH4Al(SO4)2中滴入溶液Ba(OH)2恰好使(SO4)2-沉淀完全2Ba2++4OH-+Al3++2SO42-=2BaSO4↓+AlO2-+2H2O |
| C.向溶液Mg(HCO3)2中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| D.向溶液Fe(NO3)2中加入稀氢碘酸:3 Fe2++4H+NO3-=3 Fe3++NO↑+2H2O |
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13 mol/L的溶液中:Na+、HCO3-、Cl-、Br- |
下列离子方程式正确的是
| A.铁跟盐酸反应:2Fe +6H+ ==2Fe3++3H2↑ |
| B.氯气与水反应:Cl2+H2O ="=" 2H++Cl+ClO- |
| C.硫酸与氢氧化钡溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+ H2O |
| D.金属钠与水反应:2Na +2H2O ==2Na++2OH-+H2↑ |
下列无色透明溶液中离子能大量共存的是( )
| A.Na+、Cu2+ 、NO3-、Cl- | B.Na+、Zn2+、OH-、Br- |
| C.K +、SO42-、Cl-、Mg2+ | D.Ba2+ 、Na+ 、OH-、CO32- |
下列示意图与对应的反应情况正确的是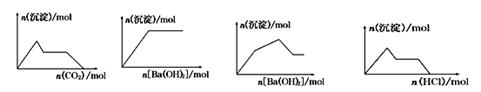
A B C D
| A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 |
| B.NaHSO4溶液中逐滴加入Ba(OH)2溶液 |
| C.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 |
| D.NaAlO2溶液中逐滴加入盐酸 |
下列说法正确的是
| A.CO2的水溶液能导电,所以CO2是电解质;液溴不导电,所以液溴是非电解质 |
| B.BaSO4不溶于水,其水溶液的导电能力极弱,所以BaSO4是弱电解质 |
| C.某物质经分析,只含有一种元素,则此物质一定是一种单质 |
| D.强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强 |
在酸性溶液中,能大量共存的离子组是
| A.K+、OH-、S042- | B.Cl-、N03-、Cu2+ |
| C.Al3+、C032-、Na+ | D.Ca2+、HC03-、NH4+ |