题目内容
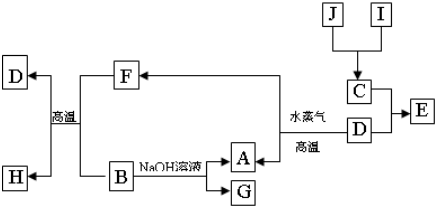
(15分)A、B、C、D是四种常见的单质,A、B为金属;C、D常温下是气体,且D为黄绿色气体。甲、乙、内为常见的化合物,甲物质具有磁性。它们之间有如图1的转化关系:
请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)含有B的阳离子的溶液与乙溶液反应得到一种白色沉淀,该反应的离子方程式是 。
(3)实验室检验丙溶液中所含金属阳离子的操作方法和现象是 。
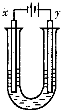
(4)电浮选凝聚法是工业上采用的一种污水处理方法,如图2是该方法处理污水的实验装置示意图,实验过程中,污水的pH始终保持在5.0~6.0之间。接通电源后,阴极产生的气体将污物带到水面形成浮渣而刮去,起到浮选净化作用;阳极产生的沉淀具有吸附性,吸附污物而沉积,起到凝聚净化作用。
阳极的电极反应分别是 ,2H2O-4e-=4H++O2↑;
阳极区生成沉淀的离子方程式是 。
(1)(3分)8Al+3Fe3O4=====4Al2O3+9Fe
(2)(3分)Al3++3AlO-2+6H2O=4Al(OH)3↓
(3)(3分)取少量丙溶液,滴入几滴KSCN溶液,若溶液变为红色,则证明有Fe3+(合理答案均给分)
(4)(6分)Fe—2e-=Fe2+,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
解析:

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为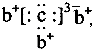 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为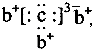 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 Al(OH)3+OH-
Al(OH)3+OH-