题目内容
取1g含SiO2和FeS2的矿石样品,在氧气中充分燃烧,残余固体质量为0.84g.用这种矿石100t,可以制得98%的H2SO4多少吨?(设生产过程中硫损失2%)
解:FeS2在氧气流中充分灼烧,完全反应后生成Fe2O3,根据Fe元素守恒可得2FeS2~Fe2O3,利用差量法计算1.00g矿石样品中FeS2的质量为,设1.00g矿石样品中FeS2的质量为m,则
2FeS2~Fe2O3 质量减少△m
240g 160g 80g
m 1.0g-0.84g=0.16g
m=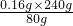 =0.48g
=0.48g
所以该黄铁矿中FeS2的质量分数为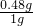 ×100%=48%.
×100%=48%.
根据S元素守恒,利用关系式发计算,反应的关系式为:FeS2~2SO2~2SO3~2H2SO4,
设制得98%的硫酸xt,
FeS2~2SO2~2SO3~2H2SO4
120g 196g
100t×98%×48% x×98%
x=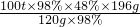 =78.4t,
=78.4t,
答:煅烧100t上述矿石,则可制得98%的硫酸78.4t.
分析:FeS2在氧气流中充分灼烧,完全反应后生成Fe2O3,根据Fe元素守恒以及利用差量法计算1g样品中FeS2的质量,进而计算FeS2的质量分数;再根据S元素守恒,利用关系式FeS2~2SO2~2SO3~2H2SO4计算生成的硫酸.
点评:本题考查化学方程式的计算,题目难度较大,注意运用差量法和关系式法计算.
2FeS2~Fe2O3 质量减少△m
240g 160g 80g
m 1.0g-0.84g=0.16g
m=
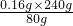 =0.48g
=0.48g所以该黄铁矿中FeS2的质量分数为
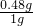 ×100%=48%.
×100%=48%.根据S元素守恒,利用关系式发计算,反应的关系式为:FeS2~2SO2~2SO3~2H2SO4,
设制得98%的硫酸xt,
FeS2~2SO2~2SO3~2H2SO4
120g 196g
100t×98%×48% x×98%
x=
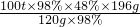 =78.4t,
=78.4t,答:煅烧100t上述矿石,则可制得98%的硫酸78.4t.
分析:FeS2在氧气流中充分灼烧,完全反应后生成Fe2O3,根据Fe元素守恒以及利用差量法计算1g样品中FeS2的质量,进而计算FeS2的质量分数;再根据S元素守恒,利用关系式FeS2~2SO2~2SO3~2H2SO4计算生成的硫酸.
点评:本题考查化学方程式的计算,题目难度较大,注意运用差量法和关系式法计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 +NO
+NO 2Cu+O2↑+4H+
2Cu+O2↑+4H+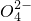 +Fe2++4H+
+Fe2++4H+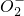 +CO2+3H2O═2Al(OH)3↓+C
+CO2+3H2O═2Al(OH)3↓+C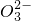



 (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是