题目内容
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如下图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全)。则下列说法与判断合理的是


| A.25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B.25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C.当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D.图中2a=b=6(c-b) |
D
试题分析:A、25℃时,Fe(OH)3的溶解度小于Al(OH)3的溶解度,错误;B、25℃时,Fe(OH)3的溶度积小于Al(OH)3的溶度积,错误;C、溶质还有硝酸钠,错误;D、正确。

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目

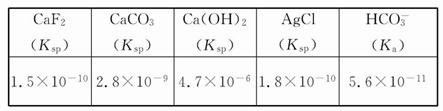
 。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为
。若某氢氧化镁溶液的PH=9,则该溶液中c(Mg2+)最大为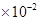 mol/L
mol/L  mol/L
mol/L
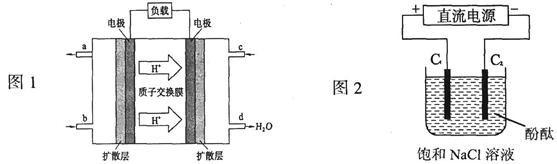
 H++A2- 完成以下问题:
H++A2- 完成以下问题: