题目内容
海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.
(1)在t1℃时,向100g水中加入150g MgCl2,形成______(填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为______.
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是______.将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有______(填字母序号).
A.MgCl2和KCl
B.只有MgSO4
C.MgCl2、KCl和MgSO4.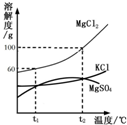
(1)在t1℃时,向100g水中加入150g MgCl2,形成______(填“饱和”或“不饱和”)溶液,将其温度升高到t2℃时,此时溶液中溶质的质量分数为______.
(2)t1℃时,MgCl2、KCl和MgSO4三种物质的饱和溶液中,溶质质量分数最大的是______.将t2℃时MgCl2、KCl和MgSO4三种物质的饱和溶液降温至t1℃时,可能会析出的晶体有______(填字母序号).
A.MgCl2和KCl
B.只有MgSO4
C.MgCl2、KCl和MgSO4.

(1)根据溶解度曲线可知:t1时,氯化镁的溶解度为60克,表示在100克水中最多溶解60克氯化镁,所以当在t1℃时,向100g水中加入150g MgCl2,形成的是饱和溶液,剩余90克氯化镁,氯化镁的溶解度受温度的升高而升高,t2℃时,氯化镁的溶解度为100克,所以,溶解100克氯化镁,形成的是饱和溶液,剩余50克氯化镁,将其温度升高到t2℃时,溶质为100克和溶剂为100克,溶质的质量分数为
×100%=50%,
故答案为:饱和;50%;
(2)由溶解度曲线示意图知,t1℃时,MgCl2的位置最高,KCl和MgSO4的曲线交于一点,故MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,根据某物质的饱和溶液中溶质质量分数
×100%知溶解度越大,浓度越大,所以,氯化镁溶液中溶质质量分数最大;
t2℃时,MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,t1℃时,MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,随着温度的降低,氯化镁和氯化钾溶解度减小,降温晶体一定析出,而硫酸镁的溶解度随着温度的降低先增大后减小,且t2℃时和t1℃时都等于氯化钾的溶解度,降温氯化钾析出,硫酸镁也析出,所以若将含有MgCl2、KCl和MgSO4三种物质的热饱和溶液降温到t1℃,析出的晶体主要是MgCl2、KCl和MgSO4三种物质的混合物,
故答案为:MgCl2; C;
| 100克 |
| 100克+100克 |
故答案为:饱和;50%;
(2)由溶解度曲线示意图知,t1℃时,MgCl2的位置最高,KCl和MgSO4的曲线交于一点,故MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,根据某物质的饱和溶液中溶质质量分数
| S |
| 100+S |
t2℃时,MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,t1℃时,MgCl2、KCl和MgSO4三种物质的溶解度的大小关系为:MgCl2>KCl=MgSO4,随着温度的降低,氯化镁和氯化钾溶解度减小,降温晶体一定析出,而硫酸镁的溶解度随着温度的降低先增大后减小,且t2℃时和t1℃时都等于氯化钾的溶解度,降温氯化钾析出,硫酸镁也析出,所以若将含有MgCl2、KCl和MgSO4三种物质的热饱和溶液降温到t1℃,析出的晶体主要是MgCl2、KCl和MgSO4三种物质的混合物,
故答案为:MgCl2; C;

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
 (2013?天河区一模)海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.
(2013?天河区一模)海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.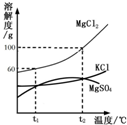 海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.
海水晒盐能够得到粗盐和卤水.卤水中含有MgCl2、KCl和MgSO4等物质,如图是它们的溶解度曲线.完成下列填空.