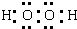题目内容
(A、B、C为短周期元素.A为常见的金属,B在常温下为固体,它的最高价氧化物的水化物D为常见强酸,C的最高价氧化物的水化物E为常见强碱.A、B、C及化合物的其转化关系如图:

请回答下列问题:
(1)写出D的化学式
 ;
;
(2)写出反应③的离子方程式
(3)标准状况下,等质量的A分别与足量的D、E反应,产生H2的体积分别为V1、V2,其关系为V1

请回答下列问题:
(1)写出D的化学式
H2SO4
H2SO4
,B与C形成的化合物的电子式为

(2)写出反应③的离子方程式
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(3)标准状况下,等质量的A分别与足量的D、E反应,产生H2的体积分别为V1、V2,其关系为V1
=
=
V2(填<、>或=).若V2=2.24l,则反应过程中转移的电子的物质的量为0.2mol
0.2mol
.分析:A为常见的金属,B在常温下为固体,它的最高价氧化物的水化物D为常见强酸判断为H2SO4,C的最高价氧化物的水化物E为常见强碱和金属A反应生成氢气,推断E为NaOH,A既可以和强酸反应也可以和强碱反应判断为Al,A和D(H2SO4)反应生成的F为硫酸铝,H为Al(OH)3,G为NaAlO2,结合上述推断得到B为硫元素,C为钠元素;根据判断进行分析回答;
解答:解:A、B、C为短周期元素,A为常见的金属,B在常温下为固体,它的最高价氧化物的水化物D为常见强酸判断为H2SO4,C的最高价氧化物的水化物E为常见强碱和金属A反应生成氢气,推断E为NaOH,A既可以和强酸反应也可以和强碱反应判断为Al,A和D(H2SO4)反应生成的F为硫酸铝,H为Al(OH)3,G为NaAlO2,结合上述推断得到B为硫元素,C为钠元素;
(1)D的化学式为:H2SO4;B与C形成的化合物为Na2S的电子式为:
故答案为:H2SO4 ;
;
(2)反应③是硫酸铝和氨水反应生成氢氧化铝沉淀的过程,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)标准状况下,等质量的A(Al)分别与足量的D(H2SO4)、E(NaOH)反应,产生H2的体积分别为V1、V2,依据电子守恒得到生成氢气体积相同;若V2=2.24l,n(H2)=0.1mol则反应过程中转移的电子的物质的量为0.2mol;
故答案为:0.2mol;
(1)D的化学式为:H2SO4;B与C形成的化合物为Na2S的电子式为:

故答案为:H2SO4
 ;
;(2)反应③是硫酸铝和氨水反应生成氢氧化铝沉淀的过程,反应的离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)标准状况下,等质量的A(Al)分别与足量的D(H2SO4)、E(NaOH)反应,产生H2的体积分别为V1、V2,依据电子守恒得到生成氢气体积相同;若V2=2.24l,n(H2)=0.1mol则反应过程中转移的电子的物质的量为0.2mol;
故答案为:0.2mol;
点评:本题考查了物质转化关系的应用,物质性质的应用,主要考查铝强碱化合物性质的应用、反应量的计算,电子式的书写,离子方程式的书写方法和判断.

练习册系列答案
相关题目
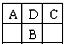 A、B、C为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法错误的是( )
A、B、C为短周期元素,在周期表中如图所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法错误的是( )| A、A的氧化物有多种形式 | B、B最高价氧化物对应的水化物是一种弱酸 | C、C的氢化物比HCl稳定 | D、D元素形成的单质不止一种 |
A、B、C为短周期元素,在周期表中如表所示:A、C两种元素的原子核外电子数之和等于B原子的核电荷数.有关说法不正确的是( )
| A | D | C |
| B |
| A、A的氧化物有多种形式 |
| B、B的最高价氧化物对应的水化物是一种强酸 |
| C、C的氢化物水溶液通常用玻璃试剂瓶盛放 |
| D、D元素形成的单质不止一种 |
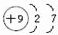
 A、B、C为短周期元素,它们的位置关系如图所示.
A、B、C为短周期元素,它们的位置关系如图所示.