题目内容
已知H+(aq)+OH-(aq) H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
 H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。
H2O(l) ΔH="-57.3" kJ·mol-1,回答下列问题。(1)用含20 g NaOH的稀溶液跟足量稀盐酸反应放出 kJ的热量。
(2)用含2 mol H2SO4的稀溶液跟足量稀NaOH反应,此反应的中和热为 。
(3)如果将(1)反应中的稀盐酸换成稀醋酸,反应放出的热量 (填“大于”“小于”或“等于”)原来(1)放出的热量。
(1)28.65 (2)57.3 kJ·mol-1 (3)小于
(1)="0.5" mol,所以0.5 mol NaOH与足量稀盐酸反应放出的热量为0.5 mol×57.3 kJ·mol-1="28.65" kJ。
(2)据中和热的定义可知,中和热与强酸、强碱的物质的量的多少无关,中和热为57.3 kJ·mol-1。
(3)因醋酸为弱酸,用NaOH中和时,需不断地电离出H+,而电离过程要吸收热量,故反应放出的热量会减小。
(2)据中和热的定义可知,中和热与强酸、强碱的物质的量的多少无关,中和热为57.3 kJ·mol-1。
(3)因醋酸为弱酸,用NaOH中和时,需不断地电离出H+,而电离过程要吸收热量,故反应放出的热量会减小。

练习册系列答案
相关题目
 2SO3(g)
2SO3(g) H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )
H2O(l) ΔH="-57.3" kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是( )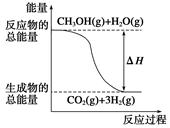
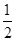 O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K____________2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒的浓度大小关系为:_______