题目内容
关于电解质溶液下列说法中不正确的是( )A.向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成蓝色Cu(OH)2沉淀,则Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
B.用等浓度的NaOH溶液中和等体积pH=2与pH=3的醋酸,所消耗的NaOH溶液的体积前者是后者的10倍
C.由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合,其离子浓度的顺序为:[
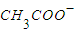 ]>[Na+]>[H+]>[OH-]
]>[Na+]>[H+]>[OH-]D.某温度下纯水中c(OH-)=2×10-7mol/L,则该温度下0.1mol/L的盐酸的pH=1
【答案】分析:A、氢氧化铜沉淀先生成,说明氢氧化铜的溶度积小于氢氧化镁的溶度积;
B、醋酸是弱电解质,氢氧化钠会促进醋酸的电离;
C、醋酸大于溶液中氢离子浓度0.001mol/L,氢氧化钠的浓度是0.001mol/L,反应后溶质是醋酸和醋酸钠混合液;
D、pH的计算公式不变,盐酸的pH=-lgc(H+)=1.
解答:解:A、溶度积越小,越容易生成沉淀,先生成蓝色Cu(OH)2沉淀,则Ksp[Mg(OH)2]>Ksp[Cu(OH)2],故A正确;
B、由于醋酸是弱电解质,部分电离,醋酸含有的氢离子大于0.001mol/L,故B错误;
C、醋酸是弱电解质,反应后生成了醋酸和醋酸钠的溶液,醋酸的电离大于醋酸根的水解,故溶液中离子浓度的顺序为:[ ]>[Na+]>[H+]>[OH-],故C正确;
]>[Na+]>[H+]>[OH-],故C正确;
D、由于pH=-lgc(H+),盐酸溶液中c(H+)=0.1mol/L,pH=-lg0.1=1,故D正确;
故选B.
点评:本题考查了醋酸的电离平衡,醋酸是弱电解质,溶液中部分电离,本题难度中等.
B、醋酸是弱电解质,氢氧化钠会促进醋酸的电离;
C、醋酸大于溶液中氢离子浓度0.001mol/L,氢氧化钠的浓度是0.001mol/L,反应后溶质是醋酸和醋酸钠混合液;
D、pH的计算公式不变,盐酸的pH=-lgc(H+)=1.
解答:解:A、溶度积越小,越容易生成沉淀,先生成蓝色Cu(OH)2沉淀,则Ksp[Mg(OH)2]>Ksp[Cu(OH)2],故A正确;
B、由于醋酸是弱电解质,部分电离,醋酸含有的氢离子大于0.001mol/L,故B错误;
C、醋酸是弱电解质,反应后生成了醋酸和醋酸钠的溶液,醋酸的电离大于醋酸根的水解,故溶液中离子浓度的顺序为:[
 ]>[Na+]>[H+]>[OH-],故C正确;
]>[Na+]>[H+]>[OH-],故C正确;D、由于pH=-lgc(H+),盐酸溶液中c(H+)=0.1mol/L,pH=-lg0.1=1,故D正确;
故选B.
点评:本题考查了醋酸的电离平衡,醋酸是弱电解质,溶液中部分电离,本题难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目