题目内容
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
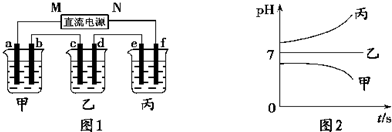
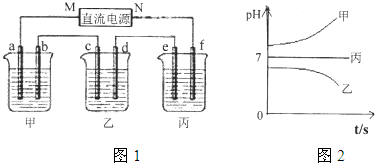
接通电源,经过一段时间后,测得乙中C电极质量增加了27克.常温下各烧杯中溶液的pH与电解时间t的关系图如图1.据此回答下列问题:

(1)M为电源的 极(填“正”或“负”);甲、乙电解质分别为 、 (填化学式).
(2)写出甲烧杯中反应的化学方程式 .
(3)有人设想用图2所示原电池为直流电源完成上述电解.则锌电极相当于直流电源的 (填“M”或“N”)极.
(4)有人设想用图3所示装置做直流电源,不仅可以完成电解也能将气体SO2 转化为重要化工原料.该设想中负极的电极反应式为 .
【答案】分析:(1)接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明C电极是阴极,连接C电极的电源电极为负极;C电极上质量增加,析出金属单质,所以乙装置中含有银离子,电解乙装置中电解质溶液,溶液的pH值减小,所以阳极上析出氢氧根离子,根据离子的放电顺序判断电解质;电解时,甲装置中溶液的pH值增大,说明阴极上氢离子放电,阳极上放电能力比氢氧根离子强的离子放电,据此判断电解质.
(2)电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,写出相应的电池反应式.
(3)图2所示原电池中,较活泼的金属作负极,所以锌作负极.
(4)图3所示装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,所以二氧化硫在负极上发生氧化反应,被氧化生成硫酸根离子.
解答:解:(1)接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明C电极是阴极,所以连接阴极的电极M是原电池的负极;电解时,甲装置中溶液的pH值增大,说明阳极上是放电能力大于氢氧根离子的离子放电,根据表格知,为氯离子,氯离子和银离子能生成沉淀,所以甲装置电解质溶液是氯化钠溶液;电解时,装置乙中pH值减小,说明阳极上是氢离子放电,溶液中含有的阴离子是含氧酸根离子,阴极上析出金属,所以含有银离子,该电解质溶液是硝酸银溶液.
故答案为:负;NaCl、AgNO3.
(2)电解氯化钠时,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,
电池反应式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.
故答案为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.
(3)图2装置中,较活泼的金属锌作负极,所以相当于M极.
故答案为:M.
(4)图3装置中,负极上失电子发生氧化反应,正极上氧气得电子发生还原反应,所以负极上的电极反应式为:
SO2+2H2O-2e-═4H++SO42-.
故答案为:SO2+2H2O-2e-═4H++SO42-.
点评:本题考查了原电池和电解池原理,明确“C电极上质量的变化”的意思是解本题的关键,根据原电池和电解质各电极上发生反应的类型即可解答本题,难度不大.
(2)电解氯化钠溶液时,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,写出相应的电池反应式.
(3)图2所示原电池中,较活泼的金属作负极,所以锌作负极.
(4)图3所示装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,所以二氧化硫在负极上发生氧化反应,被氧化生成硫酸根离子.
解答:解:(1)接通电源,经过一段时间后,测得乙中C电极质量增加了27克,说明C电极是阴极,所以连接阴极的电极M是原电池的负极;电解时,甲装置中溶液的pH值增大,说明阳极上是放电能力大于氢氧根离子的离子放电,根据表格知,为氯离子,氯离子和银离子能生成沉淀,所以甲装置电解质溶液是氯化钠溶液;电解时,装置乙中pH值减小,说明阳极上是氢离子放电,溶液中含有的阴离子是含氧酸根离子,阴极上析出金属,所以含有银离子,该电解质溶液是硝酸银溶液.
故答案为:负;NaCl、AgNO3.
(2)电解氯化钠时,阳极上氯离子放电,阴极上氢离子放电,同时生成氢氧化钠,
电池反应式为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.故答案为:2NaCl+2H2O
 2NaOH+H2↑+Cl2↑.
2NaOH+H2↑+Cl2↑.(3)图2装置中,较活泼的金属锌作负极,所以相当于M极.
故答案为:M.
(4)图3装置中,负极上失电子发生氧化反应,正极上氧气得电子发生还原反应,所以负极上的电极反应式为:
SO2+2H2O-2e-═4H++SO42-.
故答案为:SO2+2H2O-2e-═4H++SO42-.
点评:本题考查了原电池和电解池原理,明确“C电极上质量的变化”的意思是解本题的关键,根据原电池和电解质各电极上发生反应的类型即可解答本题,难度不大.

练习册系列答案
相关题目