题目内容
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题(1)该浓盐酸中HCl的物质的量浓度为
12
12
mol/L.(2)配制250mL 0.1mol/L的盐酸溶液
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
2.1 2.1 |
250 250 |
B.将已冷却的盐酸沿玻璃棒注入容量瓶中.
C.用蒸馏水洗涤
烧杯
烧杯
2-3次,洗涤液均注入容量瓶,振荡.D.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处,改用
胶头滴管
胶头滴管
加水,使溶液凹面恰好与刻度相切.E.将容量瓶盖紧,振荡,摇匀.
(3)若实验中出现下列现象对所配溶液浓度有什么影响?(填偏高、偏低、无影响)
①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
无影响
无影响
;②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,则浓度
偏低
偏低
;③定容时俯视容量瓶刻度线
偏高
偏高
.(4)实验室里迅速制备少量氯气可利用以下反应:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
此反应不需要加热,常温下就可以迅速进行.
①用“双线桥法”标明电子转移的方向和数目:
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
②用该浓盐酸制得了标况下560mlCl2,则被氧化的HCl为
0.05
0.05
mol,需要KMnO4的质量3.16
3.16
g.分析:(1)根据溶液的质量分数和物质的量浓度之间的关系公式c=
来计算;
(2)根据盐酸在稀释前后溶质的质量保持不变来回答;
(3)根据公式c=
,从影响实验结果的N和V两个方面来回答;
(4)根据氧化还原反应中,化合价升高值=化合价降低值=转移电子数来标电子转移情况,并根据化学方程式来进行相关计算.
| 1000ρw% |
| M |
(2)根据盐酸在稀释前后溶质的质量保持不变来回答;
(3)根据公式c=
| n |
| V |
(4)根据氧化还原反应中,化合价升高值=化合价降低值=转移电子数来标电子转移情况,并根据化学方程式来进行相关计算.
解答:解:(1)溶液的质量分数和物质的量浓度之间的关系公式c=
=
=12mol/L,故答案为:12;
(2)盐酸在稀释前后溶质的质量保持不变,设需要浓硫酸的体积为VmL,则1.2×V×36.5%=0.25×0.1,解得V=2.1mL,溶液的体积和容量瓶的规格相符,故选择250mL的容量瓶,固体的溶解使用少白,定容时采用胶头滴管,故答案为:2.1;250;烧杯;胶头滴管;
(3)①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,还要进行定容,所以对实验结果无影响;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,那么溶质有损失,所以导致溶质质量减少,故则浓度偏小;
③定容时俯视容量瓶刻度线,导致溶液的体积减小,所以溶液浓度偏大;
故答案为:①无影响; ②偏低;③偏高;
(4)①氧化还原反应中,化合价升高值=化合价降低值=转移电子数=10,电子转移情况如下,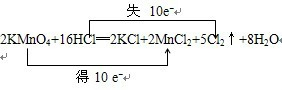 ,
,
故答案为: ;
;
②在反应中,每生成5mol的氯气,就会有16mol的盐酸参加反应,盐酸表现还原性和酸性,其中有10mol的盐酸表现还原性,被氧化,当生成氯气0.025mol时,则消耗的盐酸物质的量为
0.08mol,被氧化的盐酸为0.05 mol,消耗高锰酸钾的质量是0.01mol×316g/mol=3.16g,故答案为:0.05;3.16.
| 1000ρw% |
| M |
| 1000×1.2g/cm3×36.5% |
| 36.5g/mol |
(2)盐酸在稀释前后溶质的质量保持不变,设需要浓硫酸的体积为VmL,则1.2×V×36.5%=0.25×0.1,解得V=2.1mL,溶液的体积和容量瓶的规格相符,故选择250mL的容量瓶,固体的溶解使用少白,定容时采用胶头滴管,故答案为:2.1;250;烧杯;胶头滴管;
(3)①将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水,还要进行定容,所以对实验结果无影响;
②向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,那么溶质有损失,所以导致溶质质量减少,故则浓度偏小;
③定容时俯视容量瓶刻度线,导致溶液的体积减小,所以溶液浓度偏大;
故答案为:①无影响; ②偏低;③偏高;
(4)①氧化还原反应中,化合价升高值=化合价降低值=转移电子数=10,电子转移情况如下,
 ,
,故答案为:
 ;
; ②在反应中,每生成5mol的氯气,就会有16mol的盐酸参加反应,盐酸表现还原性和酸性,其中有10mol的盐酸表现还原性,被氧化,当生成氯气0.025mol时,则消耗的盐酸物质的量为
0.08mol,被氧化的盐酸为0.05 mol,消耗高锰酸钾的质量是0.01mol×316g/mol=3.16g,故答案为:0.05;3.16.
点评:本题考查学生配制一定物质的量浓度的溶液以及氧化还原反应方面的知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: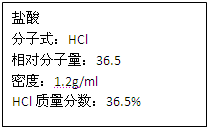 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
 如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题: 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题: