��Ŀ����
��(Ti)����Ϊ21���ͽ�����ұ���ѵ���Ҫԭ���Ǻ�Fe2O3��������FeTiO3)���������������£�
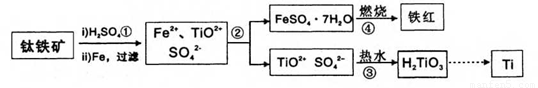
��֪��TiOSO4������ˮ����ˮ�⣬H2TiO3������ˮ���Իش��������⣺
(1)����ڵ���Ҫʵ���������ȴ���ᾧ�� (���������)���������ʵ�����г����Լ����� (���������ƣ��м�ǿ�ȡ�
(2)������м�����ˮ�������� ��
(3)�������������������(FeSO4��7H2O)�ڿ����������������졢ˮ����������д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
(4)��������õ���������������(FeSO4��7H2O)��Ŀǰ��ҵ�ϴ��������ж���ˮ���õĻ�ѧ�Լ������߷�Ӧ��(Cr��+6��ת��Ϊ+3��)����ת��Ϊ����Ҫ��ҵ��ֵ�������帴�����������FeO��FeyCrxO3��ʾ)�����Ʊ��������帴����������������Եĺ�����ˮ�У�����FeSO4��7H2O������ӦΪ��ˮ�����۸����൱��CrO3)������ ����
����13�֣�
��1������ ��2�֣� ���� ��2�֣�
��2�����ȡ�ϡ�������ڴ�ʹTiO2+ˮ������H2TiO3��2�֣�
��3��4FeSO4��7H2O+O2 2Fe2O3+4SO3+28H2O
��3�֣�
2Fe2O3+4SO3+28H2O
��3�֣�
��4�� 13.9 ��4�֣�
��������
����������������������Ĺؼ��Ǹ������ʲô���ʣ�����ʲô��Ӧ����η��룬Ҫ�����յ�����ת��Ϊ���ʵ����̡��������������Fe2O3�м���H2SO4�ܽ⣬�ټ���Fe���л�ԭ����Fe3+ת��ΪFe2+��Ȼ��ͨ����ȴ���ᾧ�����˵õ�FeSO4��7H2O�����Լ���Һ������Һ�м�����ˮ����ʹTiO2+����ˮ������H2TiO3�����ת��ΪTi��
��4��FeO��FeyCrxO3�У�CrΪ+3�ۣ�FeΪ+3�ۣ���x+y=2�����ݵ��ӵ�ʧ�غ���Fe��Cr=3:1��������x=0.5��y=1.5�����Եó����Ĺ�ϵΪ2.5FeSO4��7H2O~0.5CrO3����������Ϊ��2.5��278����0.5��100=13.9��
���㣺�����Թ�������Ϊ������������Ԫ�ؼ��������ѧʵ�����������������ԭ��Ӧ����ѧ��������֪ʶ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�