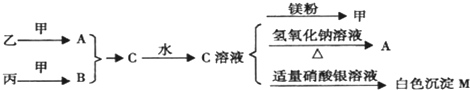
题目内容
在一定温度下,向容积为1 L的密闭容器中加入1 mol A气体和2 mol B气体,发生反应:A(g)+2B(g) 2C(g),下列情况能说明该反应达到平衡状态的是( )
2C(g),下列情况能说明该反应达到平衡状态的是( )
A.容器内A、B、C的浓度之比为1∶2∶2
B.单位时间消耗0.1 mol·L-1 A,同时消耗0.2 mol·L-1 B
C.容器内压强不随时间变化
D.容器内平均相对分子质量不随时间变化
【答案】
CD
【解析】在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,A不正确。B中反应速率的方向是相同的,不能说明,B不正确。反应前后体积是变化的,所以压强是变化的,因此当容器内压强不随时间变化时,可以说明,C正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以D可以说明。答案选CD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )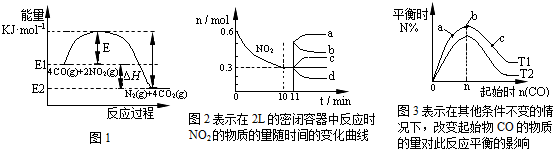

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |