��Ŀ����
��֪Zn(OH)2��Al(OH)3һ������һ�����������������ǿ�ᡢǿ�Ӧ�����ӷ���ʽ�ֱ�ΪZn(OH)2��2H��===Zn2����2H2O��Zn(OH)2��2OH��===ZnO22����2H2O����Zn(OH)2�����ڹ����İ�ˮ�ж�Al(OH)3ȴ���ܣ��䷴Ӧ�����ӷ���ʽΪZn(OH)2��4NH3��H2O===Zn(NH3)42����2OH����4H2O���������������ʵ���Һ���������õμ�˳����м������
[ ]
A��AlCl3��NH3��H2O
B��ZnCl2��NH3��H2O
C��AlCl3��NaOH
D��ZnCl2��NaOH
B��ZnCl2��NH3��H2O
C��AlCl3��NaOH
D��ZnCl2��NaOH
A

��ϰ��ϵ�д�
�����Ŀ
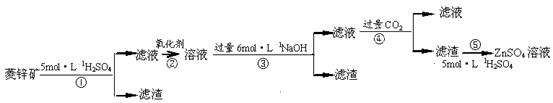
п������һ�ְ�ɫ���ϡ���ҵ������ZnSO4��BaS��Һ��϶��ɣ�BaS+ZnSO4 = ZnS��+BaSO4���������ǹ�ҵ�������̡���ش��й����⣺
��.ZnSO4��Һ���Ʊ����ᴿ
�й����ϣ���֪Zn(OH)2��Al(OH)3���ƣ������ڹ�����NaOH��Һ����Na2ZnO2��
��п�����Ҫ�ɷ���ZnCO3��������SiO2��FeCO3��Cu2(OH)2CO3�ȡ�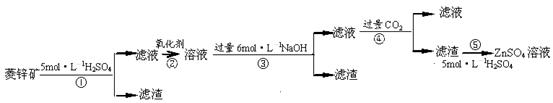 ��1������ʹ�õ���������������е� ������ţ��������� ��
��1������ʹ�õ���������������е� ������ţ��������� ��
| A��Cl2 | B��H2O2 | C��KMnO4 | D��ŨHNO3 |
��3��Ϊ�˴ﵽ�ۺ����á����ܼ��ŵ�Ŀ�ģ����������в��� ������ �������ڲ�
�� �����в���ѡ��١��ڡ��ۡ��ܡ��ݣ���
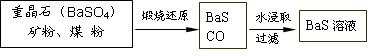
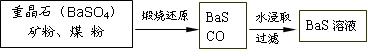
��.BaS��Һ���Ʊ�
 �й����ݣ� Ba��s����S��s����2O2��g����BaSO4��s������H = ��1473.2 kJ?mol-1
�й����ݣ� Ba��s����S��s����2O2��g����BaSO4��s������H = ��1473.2 kJ?mol-1C��s���� ��O2��g����CO��g���� ��H = ��110.5 kJ?mol-1
Ba��s���� S��s����BaS��s���� ��H = ��460 kJ?mol-1
��4�����ջ�ԭ���Ȼ�ѧ����ʽΪ: ��
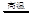 2ZnO+2SO2�� �ķ�¯�У�2C +O2
2ZnO+2SO2�� �ķ�¯�У�2C +O2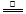 2CO
ZnO+CO
2CO
ZnO+CO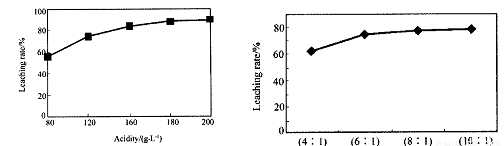
 ��1������ʹ�õ���������������е� ������ţ��������� ��
��1������ʹ�õ���������������е� ������ţ��������� ��