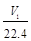题目内容
将质量为w1 g的钠铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体v1L。向溶液中加入浓度为a mol·L-1的HCl溶液的过程中有白色沉淀生成,后又逐渐溶解,当沉淀恰好消失时所加HCl溶液的体积为v2 L。将溶液蒸干灼烧得固体w2 g。下列所列等式中正确的是( )①23 g·mol-1×n(Na)+27 g·mol-1×n(Al)=w1 g
②n(Na)+3n(Al)=![]()
③33.5 g·mol-1×a mol·L-1×v2 L=w2 g-w1 g
④![]() a mol·L-1×v2 L=
a mol·L-1×v2 L=![]()
A.①② B.①②③ C.①②④ D.①②③④
C
解析:①的依据是质量守恒,钠铝合金的质量是钠、铝的质量之和。②的依据是电子守恒,钠铝失去电子数等于溶液中H+得电子数。④的依据是电荷守恒,溶液中负电荷总数(Cl-总数)等于正电荷数(Na+、Al3+所带电荷数之和)。①②④正确。溶液蒸干灼烧所得固体是NaCl和Al2O3,不是NaCl和AlCl3,③错误。

练习册系列答案
相关题目
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L.向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,测得溶液中含盐酸盐溶质共W2 g.下列所列关系式中正确的是( )
| A、35.5a=(W2-W1)V2 | ||
B、n(Na)+3n(Al)=
| ||
C、n(Al)>
| ||
D、aV2=
|
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2 L,将溶液在HCl气氛中小心蒸干得固体W2 g。下列所列关系式中正确的是
| A.35.5a=(W2-W1)V2 | B.n(Al)>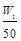 mol mol |
C.n(Na)+3n(Al)=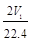 mol mol | D. aV2=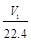 |
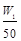 mol
mol 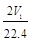 mol D. aV2=
mol D. aV2=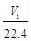
 mol
mol  mol
D. aV2=
mol
D. aV2=
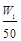 mol
mol 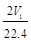 mol
D.aV2=
mol
D.aV2=