题目内容
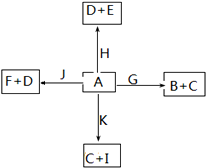
如图是中学化学中某些物质之间的相互转化关系.已知C、D、G、H、K为单质,其他为化合物;A是一种常见的液态化合物,J为淡黄色固体,E对玻璃具有很强的腐蚀性;G、K是碳素钢中的两种重要元素,其中K含量少;E、F对应溶液的酸碱性相反,F的焰色反应为黄色.请按要求作答:
(1)写出化合物E的电子式:______;
(2)写出A与J反应的化学反应方程式:______;
(3)B与足量稀硝酸反应时,当参加反应的硝酸为2mol,反应中转移电子的物质的量为______mol(保留2位有效数字);
(4)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的反应式为:______;
②若用此电池电解500mL5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,测得溶液的pH为______(保留小数点后2位,假设电解前后溶液体积不变化,已知:lg2=0.30,lg3=0.48),若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),则所得溶液中各离子浓度大小关系为:______.
(1)写出化合物E的电子式:______;
(2)写出A与J反应的化学反应方程式:______;
(3)B与足量稀硝酸反应时,当参加反应的硝酸为2mol,反应中转移电子的物质的量为______mol(保留2位有效数字);
(4)①以Pt为电极,由I、D以及F的溶液组成原电池,则负极的反应式为:______;
②若用此电池电解500mL5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,测得溶液的pH为______(保留小数点后2位,假设电解前后溶液体积不变化,已知:lg2=0.30,lg3=0.48),若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),则所得溶液中各离子浓度大小关系为:______.

A是一种常见的液态化合物,J为淡黄色固体,二者相互反应生成F与单质D,F的焰色反应为黄色,说明含有Na元素,该反应是过氧化钠与水的反应,可推知A为H2O、J为Na2O2,F为NaOH,D为O2.水与H反应生成氧气与E,E对玻璃具有很强的腐蚀性,可推知H为Cl2、E为HCl.G、K是碳素钢中的两种重要元素,其中K含量少,则G为Fe,K为C,碳与水反应生成单质C与化合物I,则C为H2、I为CO,Fe与水反应生成化合物B与氢气,则B为Fe3O4,
(1)化合物E为HF,F原子与H原子之间形成1对共用电子对,其电子式为 ,故答案为:
,故答案为: ;
;
(2)A与J反应的化学反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
(3)B为Fe3O4,与足量稀硝酸反应时,生成Fe(NO3)3与NO,令生成Fe(NO3)3为xmol,当参加反应的硝酸为2mol,则生成NO为(2-3x)mol,根据电子转移守恒可知:xmol×(3-
)=(2-3x)mol×(5-2),解得x=
,故反应中转移电子的物质的量为(2-
×3 )mol×(5-2)=0.21mol,
故答案为:0.21;
(4)①以Pt为电极,由CO、氧气以及NaOH的溶液组成原电池,CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根,则负极的反应式为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
②若用此电池电解500mL5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,则:
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
2mol 22.4L
n(NaOH) 3.36L
所以,2mol:n(NaOH)=22.4L:3.36L,解得n(NaOH)=0.3mol,故c(NaOH)=
=0.6mol/L,
故溶液中c(H+)=
mol/L,则溶液pH=-lg
=13.78,
溶液中剩余NaCl为0.5L×5mol/L-0.3mol=0.2mol,若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),其物质的量=
=0.2mol,n(NaOH):(CO2)=3:2,由于1:1<n(NaOH):(CO2):<2:1,故生成碳酸钠、碳酸氢钠,令二者的物质的量分别为:amol、bmol,由Na元素、C元素守恒可得:a+b=0.2,2a+b=0.3,解得a=0.1、b=0.1,碳酸根、碳酸氢根水解,溶液呈碱性,碳酸根的水解程度大于碳酸氢根,故c(Cl-)>c(HCO3-)>c(CO32-),溶液中钠离子浓度不变,其浓度最大,则所得溶液中各离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
故答案为:13.78;c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(1)化合物E为HF,F原子与H原子之间形成1对共用电子对,其电子式为
 ,故答案为:
,故答案为: ;
;(2)A与J反应的化学反应方程式为:2H2O+2Na2O2=4NaOH+O2↑,故答案为:2H2O+2Na2O2=4NaOH+O2↑;
(3)B为Fe3O4,与足量稀硝酸反应时,生成Fe(NO3)3与NO,令生成Fe(NO3)3为xmol,当参加反应的硝酸为2mol,则生成NO为(2-3x)mol,根据电子转移守恒可知:xmol×(3-
| 8 |
| 3 |
| 9 |
| 14 |
| 9 |
| 14 |
故答案为:0.21;
(4)①以Pt为电极,由CO、氧气以及NaOH的溶液组成原电池,CO发生氧化反应,在负极失去电子,碱性条件下生成碳酸根,则负极的反应式为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
②若用此电池电解500mL5mol/L的氯化钠溶液一段时间,两极各收集标准状况下气体3.36L,则:
2NaCl+2H2O
| ||
2mol 22.4L
n(NaOH) 3.36L
所以,2mol:n(NaOH)=22.4L:3.36L,解得n(NaOH)=0.3mol,故c(NaOH)=
| 0.3mol |
| 0.5L |
故溶液中c(H+)=
| 10-14 |
| 0.6 |
| 10-14 |
| 0.6 |
溶液中剩余NaCl为0.5L×5mol/L-0.3mol=0.2mol,若往该电解后所得溶液中通入二氧化碳气体4.48L(标准状况),其物质的量=
| 4.48L |
| 22.4L/mol |
故答案为:13.78;c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
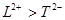
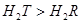
 溶液反应
溶液反应