题目内容
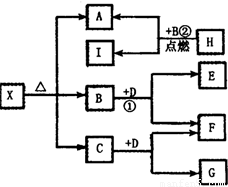
已知X是一种碱式盐,H是常见金属单质,F、I是常见非金属单质,E、C都是工业上重要的碱性物质,它们有下图所示的关系。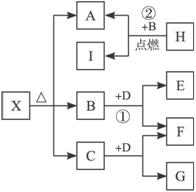
试回答下列问题:
(1)G的化学式为_________________。
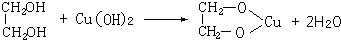
(2)写出下列反应的化学方程式
①____________________________________________________;
②____________________________________________________。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3∶8,则X的化学式为____________________。
(1)NaOH
(2)①2Na2O2+2CO2====2Na2CO3+O2
②2Mg+CO2![]() 2MgO+C
2MgO+C
③3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3等
解析:此题是无机推断题,考查了元素化合物的知识。此题的题眼是H是常见金属单质,I是常见非金属单质,又根据关系图,可知H+B====A+I,此为点燃条件下置换反应,且为金属置换非金属,初步确定为2Mg+CO2====2MgO+C,所以A为MgO,A由X分解得到,且X为碱式盐,应为碱式碳酸镁,B是CO2,C可能为H2O,二者均能和D反应,且都生成F,F是常见非金属单质,可知D为过氧化钠,F为氧气,其余可推知。(3)中根据X和盐酸反应,生成CO2的物质的量与消耗盐酸的物质的量之比为3∶8,当生成CO2是3时,消耗盐酸为6,其余盐酸相当于和OH-反应,为2。推得结果为3MgCO3·Mg(OH)2或Mg4(OH)2(CO3)3。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
 A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题:
A、B、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知A是地壳中含量最高的元素;B和Ne原子的质子数相差l;X在空气中燃烧可生成两种化合物;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.请回答下列问题: