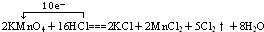题目内容
强氧化剂NaBiO3在酸性溶液中可将Mn2+氧化成Mn
自身被还原成Bi3+.取一支试管,加入适量NaBiO3固体和2mL6mol?L-1硫酸,然后滴入2mL1mol?L-1MnSO4溶液,下列说法错误的是( )
| O | - 4 |
分析:强氧化剂NaBiO3在酸性溶液中可将Mn2+氧化成MnO4-自身被还原成Bi3+,配平后的离子方程式为5BiO3-+2Mn2++14H+=2MnO4-+5Bi3++7H2O,结合反应的离子方程式和电子的转移解答该题.
解答:解:配平后的离子方程式为5BiO3-+2Mn2++14H+=2MnO4-+5Bi3++7H2O,
A.n(Mn2+)=0.002mol,n(H+)=0.024mol,可知酸过量,消耗NaBiO3的物质的量最多为0.005mol,故A错误;
B.由于生成MnO4-,则溶液颜色变为紫色,故B正确;
C.若用盐酸,可能被NaBiO3氧化,不能用盐酸代替硫酸,故C正确;
D.由氧化剂氧化性大于氧化产物氧化性可知NaBiO3的氧化性比MnO4-的氧化性强,故D正确.
故选A.
A.n(Mn2+)=0.002mol,n(H+)=0.024mol,可知酸过量,消耗NaBiO3的物质的量最多为0.005mol,故A错误;
B.由于生成MnO4-,则溶液颜色变为紫色,故B正确;
C.若用盐酸,可能被NaBiO3氧化,不能用盐酸代替硫酸,故C正确;
D.由氧化剂氧化性大于氧化产物氧化性可知NaBiO3的氧化性比MnO4-的氧化性强,故D正确.
故选A.
点评:本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型,本题可根据配平后的离子方程式计算,难度中等.

练习册系列答案
相关题目