题目内容
向NaBr与NaI的混合溶液中通入适量Cl2,反应完全后将溶液蒸干并小心灼烧至恒重,得固体W。
(1)W的可能组成为①____________;②________;③____________;④____________。(填化学式,可以多填或少填)
(2)现将NaBr与NaI的混合固体10.0 g溶于适量水中,通入448 mL Cl2(标准状况)充分反应后,按上述操作得到W的质量为7.28 g。求原混合物中NaI的质量分数。
(1)①NaCl ②NaCl、NaBr ③NaCl、NaBr、NaI (2)30.0%
解析:
(1)在混合液中通入Cl2,可发生如下反应:
2NaI+Cl2====2NaCl+I2;2NaBr+Cl2====2NaCl+Br2。
因I-比Br-的还原性强,故通入Cl2时,Cl2优先与还原性强的I-反应。灼烧时I2易升华,Br2易挥发。
当Cl2把NaI、NaBr全部氧化时,灼烧至恒重得到NaCl;当Cl2使NaI反应完全而使NaBr未反应或部分反应时,得到的固体为NaCl和NaBr的混合物;当Cl2的量很少,只能使部分NaI氧化时,燃烧所得固体为NaCl、NaBr、NaI三者的混合物。因此,W的组成可能有三种,即①NaCl,②NaCl、NaBr,③NaCl、NaBr、NaI。
(2)n(Cl2)=![]() =0.0200 mol
=0.0200 mol
①若Cl2完全反应,消耗原固体的最大质量为
mmax=m(NaI)=2×0.0200 mol×150 g\5mol-1=6.00 g<10.0 g
所以,Cl2的量不足,将完全转化为NaCl。
根据氯元素守恒生成的NaCl应为:
m(NaCl)=0.0200 mol×2×58.5 g·mol-1=2.34 g,所以W中含NaCl 2.34 g。
②如果Cl2 0.0200 mol全部与NaI反应,固体质量减少,
Δm=6.00 g-2.34 g=3.66 g>10.0 g-7.28 g=2.72 g
③若Cl2 0.0200 mol完全与NaBr反应,需NaBr的质量为:
m(NaBr)=2×0.0200 mol×103 g\5mol-1=4.12 g
固体质量减少Δm=4.12 g-2.34 g=1.78 g<10.0 g-7.28 g=2.72 g。
由此可推知Cl2与NaI反应完全,而与NaBr部分反应。所以7.28 g固体W为NaCl和NaBr的混合物。
设原固体混合物中NaI的物质的量为x。
Cl2+2NaI====I2+2NaCl Δm
1 mol 183 g
![]()
Cl2+2NaBr====Br2+2NaCl Δm
1 mol 89 g
0.0200 mol-![]()
依题意可列方程:
![]() ×183 g·mol-1+(0.0200 mol-
×183 g·mol-1+(0.0200 mol-![]() )×89 g·mol-1=10.0 g-7.28 g,解得x=0.0200 mol。
)×89 g·mol-1=10.0 g-7.28 g,解得x=0.0200 mol。
w(NaI)=![]() ×100%=30.0%
×100%=30.0%
答:原混合物中的NaI质量分数为30.0%。

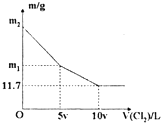 向1OO ml NaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得同体灼烧至恒重,得到m g固体.m与通入Cl2的体积
向1OO ml NaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得同体灼烧至恒重,得到m g固体.m与通入Cl2的体积(V(Cl2),标准状况〕关系如下图所示.则下列说法不正确的是( )
| A、v=0.224 | B、混合溶液中:c(Na+)=2mol/L | C、m2=25.3 | D、m1=18.55 |
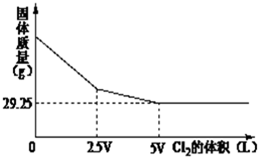 向含NaBr和NaI的溶液中,通入Cl2,充分反应后将所得的溶液蒸干、灼烧,将得到的固体冷却后称量.称量固体的质量与通入Cl2的体积关系如图所示:则原混合液中NaI的物质的质量为( )
向含NaBr和NaI的溶液中,通入Cl2,充分反应后将所得的溶液蒸干、灼烧,将得到的固体冷却后称量.称量固体的质量与通入Cl2的体积关系如图所示:则原混合液中NaI的物质的质量为( )| A、52.5g | B、60g | C、45g | D、37.5g |