题目内容
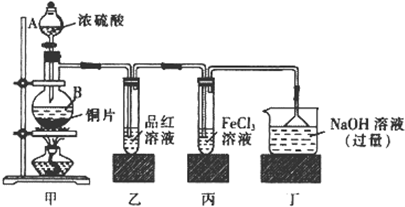
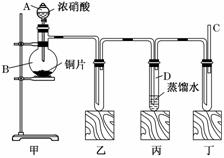
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白

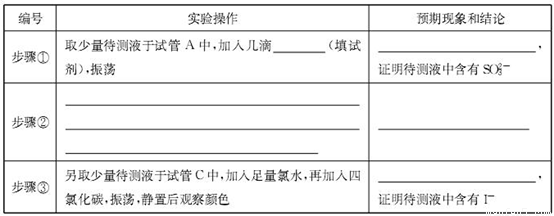
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol·L—1HCl、1mol·L—1H2SO4、1mol·L—1BaCl2、1mol·L—1Ba(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
(1)分液漏斗(1分);Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O(3分)
(2)
|
装置编号 |
实验现象 |
反应的化学方程式 |
NO2表现的化学性质 |
|
乙 |
|
|
还原性(1分) |
|
丙 |
溶液变蓝色(1分) |
NO2+2KI+H2SO4=K2SO4+I2+NO+H2O(3分) |
|
(3)I2+SO32-+H2O=2I-+SO42-+2H+(3分)
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
新制饱和溴水(1分) |
溴水褪色(1分) |
|
步骤② |
另取少量待测液于试管B中,加入过量的2 mol·L-1的盐酸,再滴加适量1 mol·L-1的 BaCl2溶液(1分) |
产生白色沉淀,证明含有SO42-(1分) |
|
步骤③ |
|
溶液分层,下层液体呈紫红色(1分) |
【解析】
试题分析:(1)根据仪器A的结构特点知,A为分液漏斗;蒸馏烧瓶B中发生的反应为浓硝酸和铜的反应,生成硝酸铜、二氧化氮和水,化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;(2)根据装置乙中的反应方程式知,二氧化氮中氮元素的化合价由+4价升高到+5价,被氧化,作还原剂,表现还原性;将二氧化氮通入试管C中,二氧化氮和水反应生成硝酸和一氧化氮,硝酸具有强氧化性将碘离子氧化生成单质碘,碘遇淀粉变蓝色,反应方程式为NO2+2KI+H2SO4=K2SO4+I2+NO+H2O;(3)向试管C滴加足量的Na2SO3溶液,溶液颜色褪去,发生的反应为在水溶液中碘和亚硫酸钠反应生成硫酸钠和氢碘酸,离子方程式为I2+SO32-+H2O=2I-+SO42-+2H+;鉴定SO32—、SO42—和I—,根据题给信息和试剂知,SO32—的检验用饱和溴水,现象为溴水褪色;SO42—检验的操作为取少量待测液于试管B中,加入过量的2 mol·L-1的盐酸,再滴加适量1 mol·L-1的 BaCl2溶液,产生白色沉淀,证明含有SO42-;I—的检验:另取少量待测液于试管C中,滴加饱和氯水和四氯化碳,振荡,溶液分层,下层液体呈紫红色,证明含有碘离子。
考点:考查化学实验基本操作、离子方程式书写和离子检验。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案