题目内容
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
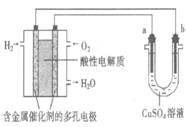
A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。
D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑ + 2H2O
【答案】
A
【解析】左边为原电池,正极 :O2+4H++4e- =2H2O 负极:2H2 -4e- =4H+
右边为电解池,若a极是铜为阳极,阳极氧化:Fe-2e-=Fe2+
b极为铁为阴极,阴极还原:Cu2+ +2e- =Cu消耗0.05mol O2转移电子0.2mol,析出 Cu0.1mol 就是6.4g铜,A正确。因为是酸性氢氧燃料电池B错误,若a极是粗铜,b极是纯铜时粗铜为阳极纯铜为阴极,a极是阳极:Cu- 2e- = Cu2+ b极是阴极:Cu2+ +2e- =Cu粗铜中有杂质,减少的不一定是铜,C错误。b极是阴极发生还原反应,D错误。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
 用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中,正确的是( )
 用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示. 下列关于此装置的说法中,正确的是( )
用酸性氢氧燃料电池为电源电解CuSO4溶液,实验装置如图所示. 下列关于此装置的说法中,正确的是( )
