题目内容
(11分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出该反应
并配平
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:
3As2S3+ 10H++ 28NO3—+ 4H2O=6H3AsO4+9SO42— +28NO↑
若生成2mol H3AsO4,则反应中转移电子的物质的量为 mol。若将该反应设计成一原电池,则NO应该在 (填“正极”或“负极”)附近逸出。
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出该反应
并配平
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:
3As2S3+ 10H++ 28NO3—+ 4H2O=6H3AsO4+9SO42— +28NO↑
若生成2mol H3AsO4,则反应中转移电子的物质的量为 mol。若将该反应设计成一原电池,则NO应该在 (填“正极”或“负极”)附近逸出。

略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 3Fe+4CO2的的中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原。
3Fe+4CO2的的中, 是氧化剂, 是还原剂, 元素被氧化, 元素被还原。  O4 = BaSO4↓+2H2O
O4 = BaSO4↓+2H2O 4与浓盐酸发生如下反应:
4与浓盐酸发生如下反应: +4H++3e-=NO+2H2O 。 已知Cu2O能使上述还原过程发生。
+4H++3e-=NO+2H2O 。 已知Cu2O能使上述还原过程发生。 _。
_。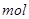 电子,则氧化产物的质量是____。
电子,则氧化产物的质量是____。 元素在化学反应中由化合态变为游离态,该元素可能被氧化也可能被还原
元素在化学反应中由化合态变为游离态,该元素可能被氧化也可能被还原