题目内容
常温下,向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示的曲线表示混合溶液的pH变化情况(溶液体积变化勿略不计)。下列说法中,不正确的是
| A.HA为一元强酸 |
| B.MOH为一元弱碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1 |
C
解析试题分析:分析图像中的pH变化曲线,起始时溶液的pH值为2,说明HA酸为一元强酸,A对;由于是向100mL0.01mol·L-1 HA溶液中逐滴加入0.02mol·L-1MOH溶液,可知当加入50mL时,两者恰好完全反应,此时溶液的pH值小于7,说明碱是一元弱碱,B对;N点时溶液中的碱稍过量,K点时碱过量较多,碱能抑制水的电离,C错;K点时pH=10,则溶液中c(MOH)+c(M+)=10-2mol·L-1,HA为一元强酸,故c(A-)=0.005mol·L-1,根据溶液中的电荷守恒,可得出:c(A-)+ c(OH-)=" c" (H+)+ c(M+),将上述两式代入可得:c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1,D对。
考点:结合图像考查了水溶液的pH值等知识。

下列关系正确的是
| A.将等物质的量的H2CO3和KHCO3溶于水配成的溶液中: 2c(K+)= c(H2CO3)+c(HCO3-) |
B.向CH3COONa溶液里加入适量的NaOH固体后得到的混合溶液中: |
C.向0.10 mol·L-1 NH4HSO4溶液中滴加适量的NaOH溶液至溶液呈中性,该中性溶液中: |
| D.向NaCN溶液中滴加适量的稀盐酸使溶液呈中性,该中性溶液中: |

对于常温下0.1mol·L-1 NaHCO3溶液,下列叙述不正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + c (H2CO3) |
| B.温度升高,溶液的pH升高,但溶液中的c(H+)与c(OH-)乘积不变 |
| C.与等体积等浓度的CH3COOH溶液反应后,溶液中c(Na+)>c(CH3COO-) |
| D.加入适量的NaOH固体,溶液的pH减小 |
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(1) [B(OH)4]-(aq)+H+(aq)。
[B(OH)4]-(aq)+H+(aq)。
下列说法正确的是
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气 泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
25℃时,有c(CH3COOH)+c(CH3COO-)=" 0." 1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
| A.X点所表示的溶液中:c(Na+)+ c(OH-) = c(CH3COO-) + c(H+) |
| B.W 点所表示的溶液中:c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=" 0." 1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10-4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0. 05mol·L-1NaOH溶液:c(H+)= c(CH3COOH)+c(OH-) |
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
Ca2+(aq)+2OH-(aq)。向悬浊液中加少量生石灰,若温度保持不变 ,下列判断正确的是 ( )
| A.溶液中Ca2+ 数目增多 | B.溶液中c(Ca2+)增大 |
| C.溶液pH值不变 | D.溶液pH值增大 |
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( ) 
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: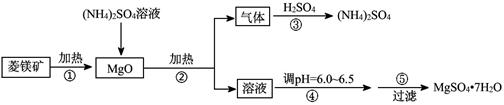
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |