题目内容
(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,下图表示上述反应能量变化的理论分析示意图:
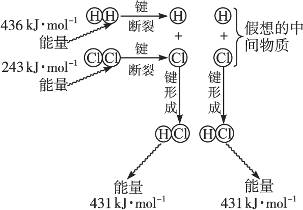
①化学键断裂需要________(填“释放”或“吸收”)能量;
②图中共释放能量________kJ·mol-1;
③该反应的反应物的总能量________(填“大于”“等于”或“小于”)反应产物的能量,所以该反应是________________反应;
④用图示数据计算其反应热,写出该反应的热化学方程式:____________________________。
(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时
C(s,石墨)+O2(g)====CO2(g);ΔH1=-393.5 kJ·mol-1 ①
CO(g)+![]() O2(g)====CO2(g);ΔH2= -283.0 kJ·mol-1 ②
O2(g)====CO2(g);ΔH2= -283.0 kJ·mol-1 ②
写出石墨在氧气中反应生成一氧化碳的热化学方程式___________________。
(1)①吸收②862③大于放热
④H2(g)+Cl2(g)====2HCl(g);ΔH=-183 kJ·mol-1
(2)C(s,石墨) +![]() O2(g)====CO(g);ΔH=-110.5 kJ·mol-+
O2(g)====CO(g);ΔH=-110.5 kJ·mol-+
解析:
(1)中④该反应的ΔH=243 kJ·mol-1+436 kJ·mol-1-431 kJ·mol-1×2=-183 kJ·mol-1,书写热化学方程式时注意方程式中的化学计量数及各物质的状态。(2)依据信息,①-②得C(s,石墨)+![]() O2(g)====CO(g);ΔH=ΔH1-ΔH2=-393.5 kJ·mol-1―(―283.0 kJ·mol-1)=-110.5 kJ·mol-1。
O2(g)====CO(g);ΔH=ΔH1-ΔH2=-393.5 kJ·mol-1―(―283.0 kJ·mol-1)=-110.5 kJ·mol-1。

有一化学反应:aA+bB====C,根据影响化学反应速率的因素可得v(C)=K[c(A)]m·[c(B)]n,其中K是与温度有关的常数,为测得K、m、n的值,在298 K时,将A、B溶液按不同浓度混合,得到下表中的实验数据:
| 编号 |
|
|
|
| 1 | 1.0 | 1.0 | 1.2×10-2 |
| 2 | 2.0 | 1.0 | 2.4×10-2 |
| 3 | 4.0 | 1.0 | 4.9×10-2 |
| 4 | 1.0 | 1.0 | 1.2×10-2 |
| 5 | 1.0 | 2.0 | 4.8×10-2 |
| 6 | 1.0 | 4.0 | 1.9×10-2 |
求:(1)由表中数据求得m、n、K的值和K的单位。
(2)若a=m,b=n,当c(A)=c(B)=2.0 mol·L-1时,求以B表示的初始反应速率。
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.