��Ŀ����
����Ŀ�����÷�Ǧ���ص�Ǧ�ࣨPbO��Pb��PbSO4�ȣ����Ʊ���ϸ��������Ʒ��3PbOPbSO4H2O �����Σ�����Ҫ�Ʊ��������£�
��1�������PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪ ��
��2����Һ1����Һ3����ɫ���������ᾧ�ɵõ��ĸ���ƷΪ��д��ѧʽ����
��3�����������ʱ�����е�Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ����Һ2��������Ҫ�ɷ�Ϊ��д��ѧʽ����
��4������ϳ����εĻ�ѧ����ʽΪ ��
��5�������ϴ�Ӳ���ʱ����������Ƿ�ϴ����ȫ�ķ����� ��
���𰸡�
��1��CO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]()
��2��Na2SO4?10H2O����Na2SO4��
��3��3Pb+8H++2NO ![]() =3Pb+2NO��+4H2O��HNO3
=3Pb+2NO��+4H2O��HNO3
��4��4PbSO4+6NaOH=3Na2SO4+3PbO?PbSO4?H2O+2H2O
��5��ȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ
���������⣺��Ǧ���м���Na2CO3��Һ��PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪCO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ���� Pb��NO3��2 �� Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO
��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ���� Pb��NO3��2 �� Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO ![]() =3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3 �� �������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4 �� ��1��ͨ�����Ϸ���֪��̼���ƺ�����Ǧ�����������ת�������ӷ���ʽΪCO
=3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3 �� �������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4 �� ��1��ͨ�����Ϸ���֪��̼���ƺ�����Ǧ�����������ת�������ӷ���ʽΪCO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ���ʴ�Ϊ��CO32��+PbSO4=PbCO3+SO
���ʴ�Ϊ��CO32��+PbSO4=PbCO3+SO ![]() ����2��ͨ�����Ϸ���֪����Һ1����Һ3����ɫ���������ᾧ�ɵõ��ĸ���ƷΪNa2SO410H2O����Na2SO4�����ʴ�Ϊ��Na2SO410H2O����Na2SO4������3��ͨ�����Ϸ���֪�������ӷ�Ӧ����ʽΪ3Pb+8H++2NO
����2��ͨ�����Ϸ���֪����Һ1����Һ3����ɫ���������ᾧ�ɵõ��ĸ���ƷΪNa2SO410H2O����Na2SO4�����ʴ�Ϊ��Na2SO410H2O����Na2SO4������3��ͨ�����Ϸ���֪�������ӷ�Ӧ����ʽΪ3Pb+8H++2NO ![]() =3Pb+2NO��+4H2O����Һ2����Ҫ�ɷ���δ��Ӧ��HNO3 �� �ʴ�Ϊ��3Pb+8H++2NO3��=3Pb+2NO��+4H2O��HNO3����4���÷�Ӧ����ʽΪ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O���ʴ�Ϊ��4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O����5���ó�����������������������ӣ��������ữ���Ȼ������飬����鷽��Ϊȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ���ʴ�Ϊ��ȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ�� ��Ǧ���м���Na2CO3��Һ��PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪCO
=3Pb+2NO��+4H2O����Һ2����Ҫ�ɷ���δ��Ӧ��HNO3 �� �ʴ�Ϊ��3Pb+8H++2NO3��=3Pb+2NO��+4H2O��HNO3����4���÷�Ӧ����ʽΪ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O���ʴ�Ϊ��4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O����5���ó�����������������������ӣ��������ữ���Ȼ������飬����鷽��Ϊȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ���ʴ�Ϊ��ȡ�������һ�ε�ϴ�ӹ���Һ���Թ��У������еμ������ữ��BaCl2��Һ������������ɫ�������������ϴ����ȫ�� ��Ǧ���м���Na2CO3��Һ��PbSO4ת��Ϊ����PbCO3�����ӷ���ʽΪCO ![]() +PbSO4=PbCO3+SO
+PbSO4=PbCO3+SO ![]() ��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ����Pb��NO3��2 �� Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO
��Ȼ����˵õ���Һ1ΪNa2SO4��Һ���������м����������ܣ�PbO��Pb��PbCO3�������ᷴӦ����Pb��NO3��2 �� Pb�����ᷴӦ������NO��Ǧ����������Pb��NO3��2��NO�����ӷ���ʽΪ3Pb+8H++2NO ![]() =3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3 �� �������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4 �� �����Ŀ�������
=3Pb+2NO��+4H2O��Ȼ������Һ�м������ᣬ����bSO4���������ˣ���Һ2����Ҫ�ɷ���HNO3 �� �������м���NaOH��Һ��������Ӧ4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O������ϴ�Ӹ���õ�3PbOPbSO4H2O����Һ3�к���Na2SO4 �� �����Ŀ�������

 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�����Ŀ�������γɶ�����̬�������NO��NO2��N2O4�ȣ���֪NO2��N2O4�Ľṹʽ�ֱ��� ![]() ��
�� 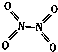 ��ʵ����N��N���ļ���Ϊ167kJmol��1 �� NO2�е������ļ���Ϊ 466kJmol��1 �� N2O4�е������ļ���Ϊ438.5kJmol��1 ��
��ʵ����N��N���ļ���Ϊ167kJmol��1 �� NO2�е������ļ���Ϊ 466kJmol��1 �� N2O4�е������ļ���Ϊ438.5kJmol��1 ��
��1��д��N2O4ת��NO2Ϊ���Ȼ�ѧ����ʽ ��
��2���Է�ӦN2O4��g��2NO2��g�������¶�T1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��
��A��C����ķ�Ӧ����v��A��v��C�����������=����������
��B��C���������ƽ����Է�������M��B��M��C�������������=����������
����״̬B����״̬A���õķ����� ��
��A���������ɫ��C����������dz������ͬ������ԭ���� ��
��3����100��ʱ����0.40mol��NO2�������2L���ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ��±���ʾ���ݣ�
ʱ��/s | 0 | 20 | 40 | 60 | 80 |
n��NO2��/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
�������������£��ӷ�Ӧ��ʼֱ��20sʱ��v��NO2��=molL��1s��1 ��
��������ͬ������������������������N2O4���壬Ҫ�ﵽ����ͬ����ƽ��״̬��N2O4����ʼŨ��Ӧ��molL��1 ��