题目内容
(2012?朝阳区二模)某废水中含有的NH4+在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+
O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol
②NO2-(aq)+
O2(g)=NO3-(aq)△H=-73kL/mol
下列叙述不正确的是( )
①NH4+(aq)+
| 3 |
| 2 |
②NO2-(aq)+
| 1 |
| 2 |
下列叙述不正确的是( )
分析:A、1mol的NH3和1mol 的NH4+都有10个电子;
B、室温下,0.1 mol/L HNO2(aq) pH>1,说明溶液中存在电离平衡,是弱酸;
C、依据热化学方程式和盖斯定律计算得到;
D、依据反应过程分析可知,①中生成氢离子,酸性增强.
B、室温下,0.1 mol/L HNO2(aq) pH>1,说明溶液中存在电离平衡,是弱酸;
C、依据热化学方程式和盖斯定律计算得到;
D、依据反应过程分析可知,①中生成氢离子,酸性增强.
解答:解:A、1mol的NH3和1mol 的NH4+都有10个电子,即10×6.02×1023个电子,故A正确;
B、0.1 mol/L HNO2(aq) pH>1,说明溶液中存在电离平衡,HNO2是弱酸,NaNO2溶液水解显碱性,故B正确;
C、①NH4+(aq)+
O2(g)=NO2-(aq)+2H+(aq)+H2O(l)△H=-273kL/mol ②NO2-(aq)+
O2(g)=NO3-(aq)△H=-73kL/mol,依据盖斯定律①+②得到NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l)△H=-346kJ/mol,故C正确;
D、在上述两次转化过程中,氢离子浓度增大,废水的酸性增大,故D错误;
故选D.
B、0.1 mol/L HNO2(aq) pH>1,说明溶液中存在电离平衡,HNO2是弱酸,NaNO2溶液水解显碱性,故B正确;
C、①NH4+(aq)+
| 3 |
| 2 |
| 1 |
| 2 |
D、在上述两次转化过程中,氢离子浓度增大,废水的酸性增大,故D错误;
故选D.
点评:本题考查热化学方程式的分析计算,微粒电子数的计算应用,弱电解质电离平衡的分析判断,盐类水解应用,题目难度中等.

练习册系列答案
相关题目
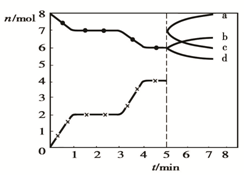 (2012?朝阳区二模)炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:
(2012?朝阳区二模)炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应: