题目内容
(13分)
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)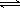 Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。
(3)液氯储存区贴有的说明卡如下(部分):
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
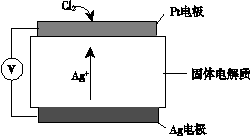
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
Cl2是一种重要的化工原料。
(1)电解饱和NaCl溶液获得Cl2的化学方程式是_______。
(2)为便于储存,要将氯气液化[ Cl2(g)
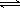 Cl2(l) ],应采取的措施是_______(写出一条即可)。
Cl2(l) ],应采取的措施是_______(写出一条即可)。(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇更物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
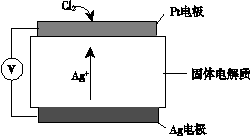
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:

(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
(13分)
(1)2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)降温 (或加压)
(3)① HSO3- + Cl2 +H2O ="=" SO42- + 2Cl- + 3H+
② 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③ Cl2 + 2e- + 2Ag+ ="=" 2AgCl
(4)① Cl2 + 2OH- ="=" Cl- + ClO- + H2O
② 分别测定通液氯样品前后a、c 的质量
(1)2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)降温 (或加压)
(3)① HSO3- + Cl2 +H2O ="=" SO42- + 2Cl- + 3H+
② 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③ Cl2 + 2e- + 2Ag+ ="=" 2AgCl
(4)① Cl2 + 2OH- ="=" Cl- + ClO- + H2O
② 分别测定通液氯样品前后a、c 的质量
试题分析:(1)电解饱和NaCl溶液生成氢氧化钠、氢气、氯气,化学方程式为2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)将氯气液化,使Cl2(g)
 Cl2(l)平衡正向移动,可以加压;气体液化是放热过程,所以还可以降低温度;
Cl2(l)平衡正向移动,可以加压;气体液化是放热过程,所以还可以降低温度;(3)①NaHSO3溶液与氯气发生氧化还原反应生成硫酸钠和氯化氢,离子方程式为HSO3- + Cl2 +H2O ="=" SO42- + 2Cl- + 3H+;
②钢瓶中含有铁,与氯气反应生成氯化铁,对苯和氯气的反应起催化作用;
③Cl2在Pt电极放电生成氯离子,与银离子结合成氯化银沉淀,从而检测氯气,电极反应式为Cl2 + 2e- + 2Ag+ ="=" 2AgCl
(4)①c装置用于吸收氯气,测定氯气的质量,离子方程式为Cl2 + 2OH- ="=" Cl- + ClO- + H2O
②该装置是检测液氯的含水量,所以需要知道氯气和水的质量,a装置吸收水,c装置吸收氯气,因此需要分别测定通液氯样品前后a、c 的质量。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g) △H<0,下列说法正确的是
CH3OH(g) △H<0,下列说法正确的是 增大
增大 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( ) Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是
Ni(CO)4(g),已知该反应在25 ℃和80 ℃时的平衡常数分别为5×104、2。下列说法正确的是  2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(气),压强一定时,测得在平衡时Z的体积分数为0.4。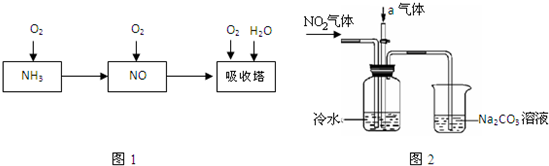
 N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。
N2O4(g)的平衡常数K= ,若NO2起始浓度为2mol/L,相同条件下,NO2的最大转化率为 。 I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是
I3-(aq),该反应的平衡常数与温度的关系如右图,下列说法不正确的是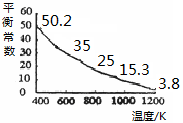
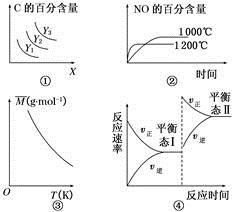
 3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1
3C(g) ΔH>0,若平衡时C的百分含量跟条件X、Y的关系如图①所示,则Y可能表示温度,X可能表示压强,且Y3>Y2>Y1 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1。若反应物起始物质的量相同,则图②可表示温度对NO的百分含量的影响 pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成m mol A 同时消耗q mol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是( )