题目内容
ⅰ已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
(1)B中所含官能团名称 ,E 物质的名称 ;
(2)反应①类型为 。
(3)写出下列反应的化学方程式(注明反应条件)
① ;
② ;
③ ;
ⅱ一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
(1)甲装置常常浸在70~80 ℃的水浴中,目的是 。
(2)由于装置设计上的缺陷,实验进行时可能会 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接 、 接丙。
ⅰ(1) 羟基(1分) 乙酸乙酯(1分)(2) 加聚反应 (1分)
(3)① n CH2=CH
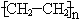 (3分)
(3分)
②2CH3CH2OH + O2 2CH3CHO + 2H2O (3分)
2CH3CHO + 2H2O (3分)
③CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)
CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)
ⅱ1.4g (3分)
ⅲ(1)使生成乙醇蒸气的速率加快且较均匀 (2分) ( “速率加快”1分,“均匀”1分)
(2)发生倒吸 (2分) (3)b a (2分)
解析试题分析:ⅰ、已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,则A分子中碳氢原子的个数之比是1:2,所以最简式为CH2。又因为A的相对分子质量小于30,所以A的化学式是C2H4,即A是乙烯。乙烯含有碳碳双键,能发生加成反应和加聚反应以及氧化反应等。由于F为高分子化合物,C中含有-CHO,E有水果的香味,所以F是聚乙烯,乙烯与水发生加成反应生成乙醇,则B是乙醇。乙醇氧化生成乙醛,即C是乙醛。乙醛氧化生成乙酸,即D是乙酸。乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸乙酯。
(1)乙醇分子中的官能团是羟基;E的名称是乙酸乙酯。
(2)乙烯发生加聚反应生成聚乙烯,所以反应①的反应类型是加聚反应。
(3)根据以上分析可知,反应①、②、③的方程式分别是是 n CH2=CH
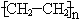 、2CH3CH2OH + O2
、2CH3CH2OH + O2 2CH3CHO + 2H2O、CH3CH2OH + CH3COOH
2CH3CHO + 2H2O、CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O。
CH3COOCH2CH3 + H2O。
ⅱ、设乙醇的物质的量为x,由关系式可知C2H5OH~3H2O
1mol 54g
x 10.8g
解得x= =0.2mol
=0.2mol
因此根据碳原子守恒可知n(CO2)+n(CO)=0.2mol×2=0.4mol
又因为m(CO2)+m(CO)=27.6g-10.8g=16.8g
设CO2和CO的物质的量分别是a和b,则44g/mol×a+28g/mol×b=16.8g、a+b=0.4mol
解得a=0.35mol、b=0.05mol
所以m(CO)=0.05mol×28g/mol=1.4g
ⅲ、(1)在反应中参加反应的是乙醇气体,由于乙醇具有挥发性,且乙醇的沸点大约是78℃,所以甲装置常常浸在70~80 ℃的水浴中目的是使生成乙醇蒸气的速率加快且较均匀。
(2)由于生成物乙醛以及乙醇都是与水易溶的,因此丁装置中导管直接插入到溶液中容易引起倒吸。
(3)连接戊装置的目的是防止倒吸的,因此要短口进,长口出,即乙接b,a接丙。
考点:考查乙烯的结构、性质以及有机物转化的有关判断;乙醇燃烧的计算;乙醇催化氧化实验设计与评价等

 名师点拨卷系列答案
名师点拨卷系列答案银镜反应是检验醛基的重要反应,教材对该实验的操作条件只是粗略的描述。某同学进行如下研究:
(1)在干净试管中加入2ml2% ,然后, 得到银氨溶液,分装入5支试管,编号为1#.2#.3#.4#.5# 。
(2)依次滴加2%.5%.10%.20%.40%的乙醛溶液4滴,快速振荡后置于60℃~70℃的水浴中。3分钟后,试管1#未形成大面积银镜,试管5# 的银镜质量差有黑斑, 试管4# 产生的银镜质量一般,试管2#.3# 形成光亮的银镜。
该研究的目的是: 。
(3)乙醛发生银镜反应的化学方程式为: ,
(4)有文献记载:在强碱性条件下,加热银氨溶液可能析出银镜。验证和对比实验如下。
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验Ⅰ | 2mL银氨溶液和数滴较浓NaOH溶液 | 有气泡产生: 一段时间后,溶液逐渐变黑:试管壁附着银镜 |
| 实验Ⅱ | 2mL银氨溶液和 数滴浓氨水 | 有气泡产生:一段时间后,溶液无明显变化 |
该同学欲分析实验Ⅰ和实验Ⅱ的差异,查阅资料后,得知:
a.Ag(NH3)2++2H2O
 Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O
Ag++2NH3·H2O b.AgOH不稳定,极易分解为黑色Ag2O经检验,实验Ⅰ的气体中有NH3,黑色物质中有Ag2O。产生Ag2O的原因是:
。
(5)用湿润的红色石蕊试纸检验NH3产生的现象是 。用稀HNO3清 洗试管壁上的Ag,该反应的化学方程式是 。
(6)该同学对产生银镜的原因提出假设:在NaOH存在下,可能是NH3还原Ag2O。如果该假设成立,则说明检验醛基时,银氨溶液不能呈强碱性,因为:








