��Ŀ����
��05���Ϻ�������B��ij��ѧ����С������ͼװ����ȡ�屽��
 �����Һ©���м��뱽��Һ�壬�ٽ����Һ�������뷴Ӧ��A��A�¶˻����رգ��С�
�����Һ©���м��뱽��Һ�壬�ٽ����Һ�������뷴Ӧ��A��A�¶˻����رգ��С�
��1��д��A�з�Ӧ�Ļ�ѧ����ʽ
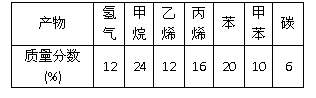
��2���۲쵽A�е������� ��
��3��ʵ�����ʱ����A�¶˵Ļ������÷�ӦҺ����B�У������Ŀ���� ��д���йصĻ�ѧ����ʽ ��
��4��C��ʢ��CCl4�������� ��
��5����֤������Һ�巢������ȡ����Ӧ�������Ǽӳɷ�Ӧ����
���Թ�D�м���AgNO3��Һ������������ɫ����������֤������һ����֤�ķ��������Թ�D�м��� �������� ���𰸣�
��1��
��2�� ��ӦҺ�� �к���ɫ�������A����
��3�� ��ȥ�����屽�е���
Br2 + 2NaOH �� NaBr + NaBrO + H2O
��3Br2 + 6NaOH �� 5NaBr + NaBrO3 + 3H2O
��4�� ��ȥ�廯�������е�������
��5�� ʯ����Һ����Һ���ɫ �����������𰸶����֣�

��05���Ϻ������ۺ���������PFS����һ������Ч�����߷������������㷺����ˮ�Ĵ�����������������Ϊԭ������ȡ�ۺ���������Ϊ����ˮ��ʱFe3+��Ũ�ȣ���ֹ������������������ԭ���е�Fe3+�����Ȼ�ԭΪFe2+��ʵ�鲽�����£�
|
��1����98%����������28%�����ᣬ����IJ�����������Ͳ�⣬���� ��
��a�� ����ƿ ��b���ձ� ��c�� ��ƿ
��2������IIȡ��������Һ�е�Fe2+��Fe3+�ĺ�����Ŀ���� ��
��a��������Һ��Fe2+��Fe3+������ ��b�� ȷ����һ����ԭ����������
��c��ȷ������Fe2+����NaClO3���� ��d�� ȷ������������������ȫ
��3����NaClO3����ʱ��Ӧ����ʽ���£�
6FeSO4 + NaClO3 + 3H2SO4 �� 3Fe2(SO4)3 + NaCl + 3H2O
������HNO3��������Ӧ����ʽ����
6FeSO4 + 2HNO3 + 3H2SO4 �� 3Fe2(SO4)3 + NO�� + 4H2O
��֪1mol HNO3�۸�0.16Ԫ��1mol NaClO3�۸�0.45Ԫ��������HNO3����NaClO3�������������ף����� ������ ��
�ۺ���������Һ��SO42¯��Fe3+���ʵ���֮�Ȳ���3:2���������й�ѡ����Լ��ͻ����������ⶨ�ۺ���������Ʒ��Һ��SO42¯��Fe3+���ʵ���֮�ȡ�
��4���ⶨʱ������Լ� ��
��a�� NaOH ��b�� FeSO4
��c�� BaCl2 ��d�� NaClO3
��5����Ҫ�ⶨ �� ����������д������Ļ�ѧʽ����
��6��ѡ���ⶨ����������Ļ������� ���������Ⱥ�˳���г�����
��a�� ��ȡ����Һ ��b�����ˡ�ϴ�� ��c���������ᾧ
��d�� ��ȴ������ ��e����ɻ�����