题目内容
向体积为2L的密闭容器中充入2mol SO2和1mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2mol SO3,则下列说法正确的是( )
分析:设平衡时转化的氧气的物质的量为x,根据同温同体积时气体的压强之比等于物质的量之比,利用三段式法计算.
2SO2+O2 2SO3
2SO3
初始 2mol 1mol 0
变化 2x x 2x
平衡 2mol-2x 1mol-x 2x
同温同体积下:
=
,
x=0.9mol,
若此时再向容器中充入2molSO3,相当于在原平衡的基础上减小体积为原来的一半,以此解答该题.
2SO2+O2
初始 2mol 1mol 0
变化 2x x 2x
平衡 2mol-2x 1mol-x 2x
同温同体积下:
| 2mol-2x+1mol-x+2x |
| 2mol+1mol |
| 0.7P |
| P |
x=0.9mol,
若此时再向容器中充入2molSO3,相当于在原平衡的基础上减小体积为原来的一半,以此解答该题.
解答:解:设平衡时转化的氧气的物质的量为x,
2SO2+O2 2SO3
2SO3
初始 2mol 1mol 0
变化 2x x 2x
平衡 2mol-2x 1mol-x 2x
同温同体积下:
=
,
x=0.9mol,
A.充入2mol SO3后,平衡向逆反应方向移动,SO2的物质的量增多,故A错误;
B.第一次反应达到平衡时共放出热量为0.9mol×196kJ?mol-1=176.4kJ,故B正确;
C.充入2 molSO3达到新平衡时,相当于在原平衡的基础上减小体积为原来的一半,平衡在原有基础上向正反应方向移动,则容器内的压强小于1.4p,故C错误;
D.降低容器的温度,平衡向正反应方向移动,平衡状态不同,故D错误.
故选B.
2SO2+O2
初始 2mol 1mol 0
变化 2x x 2x
平衡 2mol-2x 1mol-x 2x
同温同体积下:
| 2mol-2x+1mol-x+2x |
| 2mol+1mol |
| 0.7P |
| P |
x=0.9mol,
A.充入2mol SO3后,平衡向逆反应方向移动,SO2的物质的量增多,故A错误;
B.第一次反应达到平衡时共放出热量为0.9mol×196kJ?mol-1=176.4kJ,故B正确;
C.充入2 molSO3达到新平衡时,相当于在原平衡的基础上减小体积为原来的一半,平衡在原有基础上向正反应方向移动,则容器内的压强小于1.4p,故C错误;
D.降低容器的温度,平衡向正反应方向移动,平衡状态不同,故D错误.
故选B.
点评:本题考查化学平衡的计算,题目难度中等,解答本题的关键是根据压强的变化利用三段式法计算平衡时各物质的浓度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
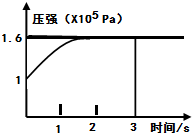 (2013?达州模拟)一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应:
(2013?达州模拟)一定温度下,向体积为2L的恒容密闭容器中充入1mol PCl5(g),发生反应: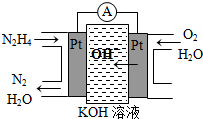 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题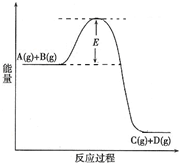 (2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.
(2010?陕西模拟)已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.