题目内容
某化学兴趣小组为探究SO2的性质,查阅相关资料知:实验室制取SO2气体的反应原理为Na2SO3+H2SO4
| ||

请回答下列问题:
(1)盛装浓硫酸的仪器的名称是
(2)按上图连接好装置再
(3)实验过程中,装置B、C中可观察到的实验现象分别是
(4)D中可观察到的现象是
(5)装置E的作用是
分析:(1)依据装置图和仪器的用途分析回答仪器名称;
(2)为确保实验能够顺利进行,制取气体的装置要检查气密性;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色;酸可以使紫色石蕊试液变红;
(4)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性;
(5)二氧化硫是大气污染物,氢氧化钠溶液能吸收二氧化硫;
(2)为确保实验能够顺利进行,制取气体的装置要检查气密性;
(3)二氧化硫与品红化合生成无色物质,能使品红溶液褪色;酸可以使紫色石蕊试液变红;
(4)酸性KMnO4具有强氧化性,溶液颜色为紫色,SO2中+4价S具有还原性;
(5)二氧化硫是大气污染物,氢氧化钠溶液能吸收二氧化硫;
解答:解:(1)盛装浓硫酸仪器的名称是分液漏斗,便于控制浓硫酸的滴加速率,防止气体逸出,
故答案为:分液漏斗;
(2)该实验目的是探究SO2的性质,所以装置连接好之后,装药品之前必须检查装置的气密性,
故答案为:检查装置的气密性;
(3)装置B中装有品红溶液,实验过程中,二氧化硫与品红化合生成无色物质,品红溶液褪色;装置C中装有石蕊试液,二氧化硫与水反应生成亚硫酸,亚硫酸能使石蕊试液变红,
故答案为:品红溶液褪色;石蕊试液变红;
(4)二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:KMnO4溶液褪色;还原;
(5)二氧化硫遇水能与水反应生成亚硫酸,亚硫酸随雨水降落而形成酸雨,为防止污染环境,装置E的作用是利用NaOH溶液吸收SO2,生成亚硫酸钠和水,反应的化学方程式为2NaOH+SO2═Na2SO3+H2O,
故答案为:吸收SO2,防止污染环境;
故答案为:分液漏斗;
(2)该实验目的是探究SO2的性质,所以装置连接好之后,装药品之前必须检查装置的气密性,
故答案为:检查装置的气密性;
(3)装置B中装有品红溶液,实验过程中,二氧化硫与品红化合生成无色物质,品红溶液褪色;装置C中装有石蕊试液,二氧化硫与水反应生成亚硫酸,亚硫酸能使石蕊试液变红,
故答案为:品红溶液褪色;石蕊试液变红;
(4)二氧化硫通入酸性高锰酸钾中发生2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,该反应中二氧化硫为还原剂,具有还原性,发生氧化反应,导致酸性KMnO4溶液褪色,
故答案为:KMnO4溶液褪色;还原;
(5)二氧化硫遇水能与水反应生成亚硫酸,亚硫酸随雨水降落而形成酸雨,为防止污染环境,装置E的作用是利用NaOH溶液吸收SO2,生成亚硫酸钠和水,反应的化学方程式为2NaOH+SO2═Na2SO3+H2O,
故答案为:吸收SO2,防止污染环境;
点评:本题考查了SO2的性质的实验设计和性质分析判断,掌握二氧化硫酸性氧化物性质、漂白性、还原性等是解题关键,题目难度中等.

练习册系列答案
相关题目
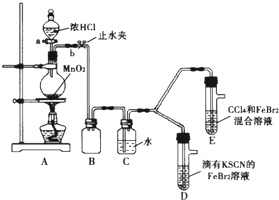 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出
用改正后的装置进行实验.实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
| Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因
 某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
某化学兴趣小组为探究铜跟浓硫酸的反应,如图所示装置进行有关实验.
 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.
某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验.

