题目内容
下列关于原子结构、元素性质的说法正确的是
A.原子结构随着元素原子序数的递增而呈周期性变化,这个规律叫元素周期律
B.第三周期元素的简单离子半径随原手序数的递增依次增大
C.第ⅦA族元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱
D.16O2与18O2互为同位素,它们的性质基本相同
【答案】
C
【解析】
试题分析:A、元素周期律是指元素性质随原子序数的递增呈周期性变化,故A错误;B、第三周期元素的简单阳离子半径随原子序数的递增而减小,简单阴离子随原子序数的递增而减小,但阳离子半径均小于阴离子半径,故B错误;C、同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,但相应阴离子的还原性逐渐增强,所以第ⅦA族元素的简单阴离子还原性越强,其气态氢化物的稳定性越弱故C正确;D、同位素是指质子数相同,中子数不同的同一种元素的不同核素互称为同位素,即同位素研究对象是原子,16O2与18O2为同一种物质,都是氧气,故D错误,答案选C。
考点:考查元素周期律、微粒半径、氢化物稳定性和还原性以及同位素的判断等

练习册系列答案
相关题目
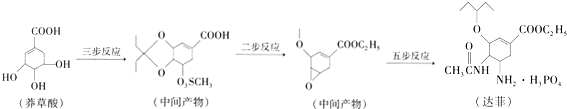
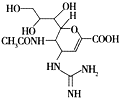




 ,关于盐酸乙哌立松片有下列说法:
,关于盐酸乙哌立松片有下列说法: