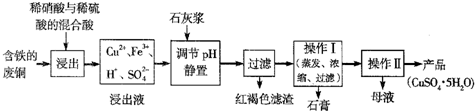
题目内容
CuSO4?5H2O是铜的重要化合物,有着广泛的应用.以下是CuSO4?5H2O的实验室制备流程图.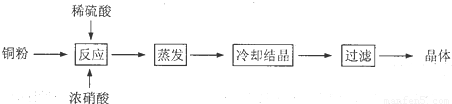
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:______、______.
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4?5H2O中可能存在的杂质是______,除去这种杂质的实验操作称为______.
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4称取0.1000g提纯后的CuSO4?5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4?5H2O______g.
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用______.在滴定中,准确读数应该是滴定管上蓝线______所对应的刻度.
(5)如果采用重量法测定CuSO4?5H2O的含量,完成下列步骤:①______②加水溶解③加氯化钡溶液,沉淀④过滤(其余步骤省略)在过滤前,需要检验是否沉淀完全,其操作是______
(6)如果1.040g提纯后的试样中含CuSO4?5H2O的准确值为1.015g,而实验测定结果是l.000g 测定的相对误差为______.
【答案】分析:(1)根据铜与浓硝酸反应的产物判断现象;
(2)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;
(3)根据氢氧化钠的物质的量求出硫酸铜的物质的量,进而求出质量;
(4)滴定管使用前要洗涤并用用标准液润洗,防止测定浓度偏小;在滴定中,准确读数应该是滴定管上蓝线粗细交界点;
(5)测量固体的含量,要先称量一定质量的固体,经溶解、沉淀、过滤、干燥、称量等操作,要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(6)相对误差为相对值除以准确值.
解答:解:(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,故答案为:溶液呈蓝色,有红棕色气体生成;
(2)混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离,故答案为:Cu(NO3)2、重结晶;
(3)根据化学方程式计算,所含硫酸铜晶体的质量为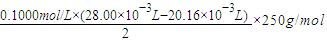 ═0.0980g,故答案为:0.0980g;
═0.0980g,故答案为:0.0980g;
(4)滴定管要用标准液润洗,准确读数应该是滴定管上蓝线粗细交界点,故答案为:标准盐酸溶液润洗2~3次;粗细交界点;
(5)沉淀需要洗涤,且要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全,故答案为:在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生;
(6)相对误差为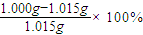 ═-1.48%,故答案为:-1.5%(-1.48%).
═-1.48%,故答案为:-1.5%(-1.48%).
点评:本题主要考察实验现象等观察、物质的提纯,中和滴定、实验过程设计及有关计算,注意滴定管的使用,以及相对误差的计算方法.
(2)根据反应物判断可能存在的杂质,溶解度不同的可溶性盐可用重结晶法分离;
(3)根据氢氧化钠的物质的量求出硫酸铜的物质的量,进而求出质量;
(4)滴定管使用前要洗涤并用用标准液润洗,防止测定浓度偏小;在滴定中,准确读数应该是滴定管上蓝线粗细交界点;
(5)测量固体的含量,要先称量一定质量的固体,经溶解、沉淀、过滤、干燥、称量等操作,要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全;
(6)相对误差为相对值除以准确值.
解答:解:(1)铜与浓硝酸反应为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成硫酸铜和二氧化氮气体,故答案为:溶液呈蓝色,有红棕色气体生成;
(2)混有硝酸铜杂质,需利用溶解度的不同,用重结晶的方法进行分离,故答案为:Cu(NO3)2、重结晶;
(3)根据化学方程式计算,所含硫酸铜晶体的质量为
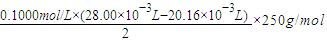 ═0.0980g,故答案为:0.0980g;
═0.0980g,故答案为:0.0980g;(4)滴定管要用标准液润洗,准确读数应该是滴定管上蓝线粗细交界点,故答案为:标准盐酸溶液润洗2~3次;粗细交界点;
(5)沉淀需要洗涤,且要验证是否洗涤完全,向上层清液中继续滴加加氯化钡溶液,若有沉淀产生说明还没有沉淀完全,故答案为:在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生;
(6)相对误差为
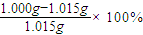 ═-1.48%,故答案为:-1.5%(-1.48%).
═-1.48%,故答案为:-1.5%(-1.48%).点评:本题主要考察实验现象等观察、物质的提纯,中和滴定、实验过程设计及有关计算,注意滴定管的使用,以及相对误差的计算方法.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列叙述不正确的是( )
| A、利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | B、用品红溶液可区分二氧化碳和二氧化硫 | C、用CuSO4?5H2O检验酒精中含有的水 | D、焰色反应为黄色的某溶液中一定含有Na+ |