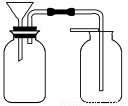
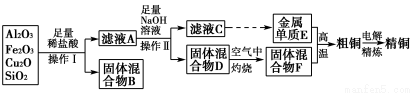
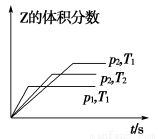
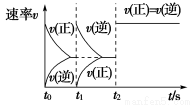
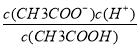题目内容
该同学利用制得的CuSO4溶液及如图所示装置,进行以下实验探究。
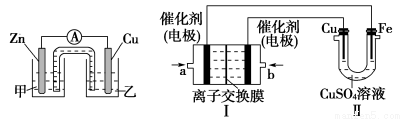
图一 图二
(1)图一是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。Cu极的电极反应式是_____________________________________________________,
盐桥中是含有琼胶的KCl饱和溶液,电池工作时K+向________(填“甲”或“乙”)池移动。
(2)图二中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是________(填“CH4”或“O2”),a处电极上发生的电极反应是_____________________________________________;
当铜电极的质量减轻3.2 g时,消耗的CH4在标准状况下的体积为________L。
(1)Cu2++2e-=Cu 乙
(2)O2 CH4-8e-+10OH-=CO32—+7H2O 0.28
【解析】 (1)铜锌原电池中,较不活泼的铜作正极,正极发生还原反应,即Cu极的电极反应式为Cu2++2e-=Cu,原电池工作时,阳离子向正极方向移动,即向乙池移动。(2)要想实现铁上镀铜,则铁作阴极,铜作阳极,即b处电极为正极,a处电极为负极,则b处通O2;a处电极上发生氧化反应,即CH4-8e-+10OH-=CO32—+7H2O。由电子守恒可知,铜电极质量减轻3.2 g,即0.05 mol Cu参与反应,转移电子0.1 mol,则:
CH4 ~ 8e-
22.4 8
V 0.1
解得V=0.28,即消耗的甲烷在标准状况下的体积为0.28 L。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案某化学小组的同学到实验室学习。在实验桌上摆有如图所示仪器:
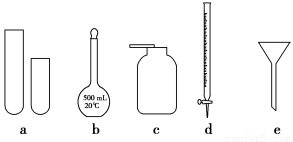
(1)指导教师要求同学们写出仪器的名称,某同学书写的答案如下表,请你找出其中的错误,将改正后的名称填写在下表中(若正确,则此空不需要填写)。
仪器编号 | a | b | c | d | e |
名称 | 试管 | 溶量瓶 | 集气瓶 | 碱式滴定管 | 普通漏斗 |
改正的名称 |
|
|
|
|
|
(2)甲同学想用d进行实验,请你说出该仪器(已经洗涤干净)使用时的第一步操作: 。
(3)关于e的用途,乙同学说可组成防倒吸装置。你还能说出其他两种用途吗?
① ;
② 。
(4)丙同学想用如图所示装置用大理石和稀盐酸反应制取CO2。老师指出,这需要太多的稀盐酸,会造成浪费,该同学选用了上面的一种仪器,加在装置中,解决了这个问题。请你把该仪器画在图中合适的位置。