题目内容
某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色.
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成.
下列关于该澄清溶液的说法中错误的是( )
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色.
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成.
下列关于该澄清溶液的说法中错误的是( )
分析:根据题干提供的信息结合物质的性质进行,①碘水呈棕黄色,碘单质遇到淀粉显蓝色;
②碳酸钡沉淀可以和盐酸反应生成氯化钡、水以及二氧化碳.
②碳酸钡沉淀可以和盐酸反应生成氯化钡、水以及二氧化碳.
解答:解:①通入足量氯气,溶液变为棕黄色,则为碘的颜色,碘淀粉溶液后溶液显蓝色,则一定含有碘离子;
②加入BaCl2有白色沉淀生成,则沉淀是碳酸钡,再加入足量盐酸后,碳酸钙沉淀完全溶解,并有气体二氧化碳生成,所以一定含有碳酸根离子,
综上可知一定含有碘离子和碳酸根离子,可能含有氯离子.
故选D.
②加入BaCl2有白色沉淀生成,则沉淀是碳酸钡,再加入足量盐酸后,碳酸钙沉淀完全溶解,并有气体二氧化碳生成,所以一定含有碳酸根离子,
综上可知一定含有碘离子和碳酸根离子,可能含有氯离子.
故选D.
点评:本题考查了混合物成分的鉴别,完成此题,可以依据物质的性质进行,难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
某澄清溶液中可能含有下列离子:Na+、NH4+、Fe2+、Fe3+、Ba2+、SO42-、HCO3-、Cl-.对其进行如下实验:
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀.
下列关于该溶液的说法中正确的是( )
①用玻璃棒蘸取该溶液滴在pH试纸上,试纸显红色;
②另取少量溶液加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀;
③取②中上层清液 加入酸化硝酸银溶液,也生成白色沉淀.
下列关于该溶液的说法中正确的是( )
| A、该溶液中一定不存在Ba2+和HCO3- | B、取③中滤液加入KSCN,溶液显红色,则原溶液中一定有Fe3+ | C、该溶液中一定存在SO42-和Cl- | D、另取该溶液加少贵NaOH溶液,微热,试管口的湿润红色石蕊试纸不变蓝,则原 溶液中一定不存在NH4+ |
 、
、 、
、 、
、 、
、 中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入
中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入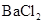 有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入
有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入 溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是( )
溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是( ) 、
、 、
、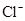 、
、 、
、 中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入
中的一种或几种,现分别取少量溶液做如下实验: ①通人足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色②加入 有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入
有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。③用铂丝醮取少量溶液置于酒精灯火焰中灼烧,火焰的颜色呈黄色④加入 溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是( )
溶液并加热,无明显现象。下列关于该澄清溶液的说法不正确的是( )