题目内容
晶体是质点(分子、离子、或原子)在空间有规则地排列的,具有整齐外形,以多面体出现的固体物质.在空间里无限地周期性的重复能成为晶体的具有代表性的最小单元,称为晶胞.一种Al-Fe合金的立体晶胞如图所示.(1)确定该合金的化学式 .
(2)若晶胞的边长=a nm,计算此合金的密度 (不必化简)g/cm3.
(3)取一定质量的该合金粉末溶于足量的稀NaOH溶液中,待反应完全停止后得到气体6.72L.过滤,将残渣用蒸馏水洗净后,取其质量的十分之一,投入100mL一定浓度的稀硝酸中,恰好完全反应,共收集到气体0.672L,求硝酸的物质的量浓度.(写分析过程,以上气体体积均在标准状况下测定)

【答案】分析:(1)利用均摊法计算晶胞化学式;
(2)根据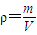 计算;
计算;
(3)根据反应的关系式Fe~HNO3~Fe(NO3)2~NO和 Fe~HNO3~Fe(NO3)3~NO计算.
解答:解:(1)根据晶胞的结构可知,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,则晶胞平均含有Fe的个数为:8× +6×
+6× +12×
+12× +1=8,
+1=8,
晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,
n(Fe):n(Al)=2:1,所以化学式为Fe2Al,
故答案为:Fe2Al;
(2)一个晶胞中含有8个Fe原子和4个Al原子,则质量为:m=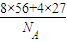 g,
g,
体积为:(a×10-7)3cm3,
所以晶胞的密度为: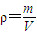 =
=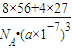 g/cm3,
g/cm3,
故答案为: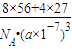 ;
;
(3)Fe~HNO3~Fe(NO3)2~NO
3 8 3 2
Fe~HNO3~Fe(NO3)3~NO
1 4 1 1
根据铁和稀硝酸的反应,不管铁被氧化到什么价态,均有
n(HNO3)=4n(NO)=4×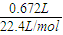 =0.12mol
=0.12mol
c(HNO3)=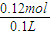 =1.2mol/L.
=1.2mol/L.
答:硝酸的物质的量浓度为1.2mol/L.
点评:本题考查晶胞的计算和化学方程式的计算,题目难度中等,本题易错点为(3),注意关系式的利用.
(2)根据
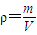 计算;
计算;(3)根据反应的关系式Fe~HNO3~Fe(NO3)2~NO和 Fe~HNO3~Fe(NO3)3~NO计算.
解答:解:(1)根据晶胞的结构可知,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,则晶胞平均含有Fe的个数为:8×
 +6×
+6× +12×
+12× +1=8,
+1=8,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,
n(Fe):n(Al)=2:1,所以化学式为Fe2Al,
故答案为:Fe2Al;
(2)一个晶胞中含有8个Fe原子和4个Al原子,则质量为:m=
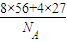 g,
g,体积为:(a×10-7)3cm3,
所以晶胞的密度为:
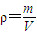 =
=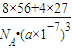 g/cm3,
g/cm3,故答案为:
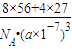 ;
;(3)Fe~HNO3~Fe(NO3)2~NO
3 8 3 2
Fe~HNO3~Fe(NO3)3~NO
1 4 1 1
根据铁和稀硝酸的反应,不管铁被氧化到什么价态,均有
n(HNO3)=4n(NO)=4×
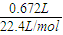 =0.12mol
=0.12molc(HNO3)=
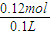 =1.2mol/L.
=1.2mol/L.答:硝酸的物质的量浓度为1.2mol/L.
点评:本题考查晶胞的计算和化学方程式的计算,题目难度中等,本题易错点为(3),注意关系式的利用.

练习册系列答案
相关题目