题目内容
某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
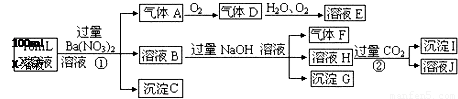
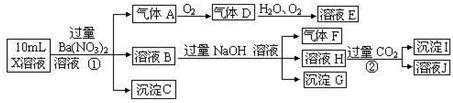
根据以上信息,回答下列问题:
(1)气体F为
(2)上述离子中,溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子是 .
(3)写出生成A的离子方程式:
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式 .
(5)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,且不能确定的离子只有一种。当X溶液中不能确定的离子是 ,则沉淀C的物质的量为
(1)NH3 (1分)
(2)Al3+、NH4+、Fe2+、SO42-; (1分) Fe3+、Cl- (1分)
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O (2分)
(4)3ClO—+2Fe(OH)3+4OH—=3Cl—+2FeO42—+5H2O (2分)
(5)Fe3+, (1分) 大于0.7mol (1分)或Cl- 小于 0.7mol
【解析】
试题分析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中通入过量的CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,故答案为:(1)气体F为NH3;(2)Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;(3)Fe2+离子被氧化为Fe3+离子,同时生成NO,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
(4)根据题意反应方程式为:3ClO—+2Fe(OH)3+4OH—=3Cl—+2FeO42—+5H2O
(4)A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)= 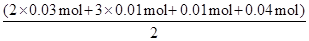 =0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,故答案为:大于0.07mol,Fe3+(或者小于0.07mol,Cl-)
=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离子,故答案为:大于0.07mol,Fe3+(或者小于0.07mol,Cl-)
考点:考查离子组推断题相关知识



 ▲ 。
▲ 。
