题目内容
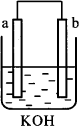
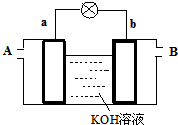 以多孔铂为电极,在如图装置中分别在两极区通入CH3OH和O2,发生反应产生电流,经测定,电流方向由b到a,下列叙述中正确的是( )
以多孔铂为电极,在如图装置中分别在两极区通入CH3OH和O2,发生反应产生电流,经测定,电流方向由b到a,下列叙述中正确的是( )分析:燃料原电池中,甲醇失电子发生氧化反应,所以通入燃料的电极为负极,电池反应式为:CH3OH-6e-+8OH-=C032-+6H2O,通入氧化剂氧气的电极为正极,电池反应为,2H2O+O2↑+4e-=4OH-,题中电流方向由b到a,说明a为负极,b为正极,以此解答该题.
解答:解:A.电流方向由b到a,说明a为负极,b为正极,在A处应通入CH3OH,故A错误;
B.溶液中的阳离子向正极移动,即向b极移动,故B错误;
C.通入燃料的电极为负极,电池反应式为:CH3OH-6e-+8OH-=C032-+6H2O,故C正确;
D.由以上分析可知b为正极,故D错误.
故选C.
B.溶液中的阳离子向正极移动,即向b极移动,故B错误;
C.通入燃料的电极为负极,电池反应式为:CH3OH-6e-+8OH-=C032-+6H2O,故C正确;
D.由以上分析可知b为正极,故D错误.
故选C.
点评:本题考查碱性甲醇电池的工作原理,题目难度不大,注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意归纳电子、电流、离子的流向.

练习册系列答案
相关题目