题目内容
过量铁粉与稀硝酸反应的方程式为:
3Fe + 8HNO3 (稀)= 3Fe(NO3)2 + 2NO↑ + 4H2O
① 标出电子转移的方向和数目
② 该反应的氧化剂是 ,还原产物是 ;
③ 标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移的电子总数为个,有 mol氧化剂被还原。
3Fe + 8HNO3 (稀)= 3Fe(NO3)2 + 2NO↑ + 4H2O
① 标出电子转移的方向和数目
② 该反应的氧化剂是 ,还原产物是 ;
③ 标准状况下,当生成2.24L NO气体时, 有 g Fe参加反应,转移的电子总数为个,有 mol氧化剂被还原。
①
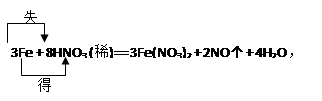
② HNO3,NO ③8.4,0.3NA,0.1
试题分析:反应中Fe由0价升为+2价,每3molFe反应,失6mole-。N由+5价降为+2价,每生成2molNO转移6mole-。还原剂是Fe、氧化剂是硝酸、氧化产物是硝酸亚铁、还原产物是NO。每生成1molNO,有1.5molFe反应,转移3mole-,有1molHNO3被还原。
点评:氧化还原反应中,还原剂失电子、被氧化、生成氧化产物;氧化剂得电子、被还原、生成还原产物。

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
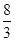 mol
mol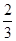 mol
mol O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
O,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )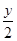 ,R3+是还原剂
,R3+是还原剂