题目内容
(10分)(混合物平均摩尔质量通常可表示为: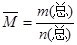 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度____(选填“>”、“<”或“=”)干燥空气的密度,理由是___________________________________________________________________;
(2)在一定条件下的密闭容器中,以碳和水蒸气为反应物,发生反应:
C(s)+H2O(g) CO(g)+H2(g);达到平衡后保持温度不变并加压,则
CO(g)+H2(g);达到平衡后保持温度不变并加压,则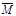 (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”);
(3)以物质的量之比为1:2相混合的Na2SO3和K2SO3的混合物共a g,与足量盐酸反应生成的SO2物质的量n(SO2)=____________mol(用含a的代数式表示)。
⑴<(2分); 因为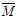 (空气)=29g/mol,M(H2O)=18g/mol,
(空气)=29g/mol,M(H2O)=18g/mol,
则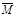 (总)必小于29g/mol;(3分)
(总)必小于29g/mol;(3分)
⑵变大(2分);⑶3a/442 mol(3分)
【解析】(1)由题意知,潮湿空气与干燥空气相比显然潮湿空气比干燥空气的含水量大,而空气的平均式量是29g/mol,水的式量是18g/mol,因此,潮湿空气的式量必定小于29g/mol,即有潮湿空气的密度小于干燥空气的密度。
(2)原平衡时,混合气体可看成是H2O(g)、CO(g)和H2(g)两部分组成,而 CO(g)与H2(g)的物质的量一定相等,这一部分气体的平均式量为15g/mol,整个混合气体的平均式量位于15g/mol~18g/mol之间。在题设条件下,增大压强,平衡将向逆方向移动,H2O(g)的物质的量的含量增大,故混合气体的平均式量增大。
(3)假设Na2SO3为x mol,则K2SO3为2xmol,由题意有:
126x+158×2x=a g x=a/442 mol 则:n(SO2)= 3a/442 mol

 名校课堂系列答案
名校课堂系列答案(8分)混合物平均摩尔质量通常可表示为: ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度 (选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g) 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡 (填“正向移动”、“逆向移动”、“不移动”), (混合气)将 (填写“变大”、“变小”或“不变”);
(混合气)将 (填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
| A.混合气体的平均相对分子质量 | B.混合气体的密度 |
| C.B的物质的量浓度 | D.气体的总物质的量 |
 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题: 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡
(填“正向移动”、“逆向移动”、“不移动”),
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡
(填“正向移动”、“逆向移动”、“不移动”),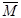 (混合气)将
(填写“变大”、“变小”或“不变”);
(混合气)将
(填写“变大”、“变小”或“不变”); C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是