题目内容
下列离子方程式或化学方程式与所述事实相符且正确的是( )
A.H218O中投入Na2O2固体:2H218O+2O22—=4OH-+18O2↑
B.向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:H++OH- =H2O
C.以金属银为阳极电解饱和硫酸铜溶液:Cu2++2H2O=2Cu+O2↑+4H+
D.NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42—完全沉淀:Al3++2SO42—+2Ba2++4OH-=AlO2—+2BaSO4↓+2H2O
B
【解析】Na2O2为过氧化物,在离子方程式中不能“拆开”,A项错误;由0.1 mol·L-1 NaHA溶液的pH=1可知其完全电离,B项正确;活性电极作阳极则电极材料本身失电子,C项错误;Al(OH)3不溶于氨水,D项错误

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32—、SiO32—、AlO2—、Cl- |
阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
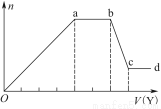
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
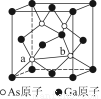
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。