题目内容
控制合适的条件,将反应2Fe3++2I- 2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是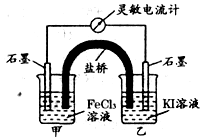
| A.盐桥中的K+移向FeCl3溶液 |
| B.反应开始时,乙中石墨电极上发生氧化反应 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极 |
D
解析试题分析:反应2Fe3++2I-?2Fe2++I2可知,铁元素的化合价降低,而碘元素的化合价升高,则图中甲烧杯中的石墨作正极,乙烧杯中的石墨作负极。A、根据电流方向,K+移向正极,即移向FeCl3溶液,正确;B、因乙中I-失去电子放电,元素的化合价升高,则发生氧化反应,正确;C、当电流计为零时,说明没有电子发生转移,则反应达到平衡,正确;D、当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,正确。
考点:本题考查原电池的工作原理、正负极的判断方法、化学平衡的移动。

关于铜电极的叙述中不正确的是
| A.铜锌原电池中铜是正极 |
| B.在镀件上镀铜时可用金属铜作阳极 |
| C.用电解法精炼铜时粗铜做阳极 |
| D.用电解法精炼铜时纯铜做阳极 |
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”获得2011年诺贝尔化学奖。某准晶体由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投人烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
| A.在烧杯①中,若构成微型电池,负极反应式为2H2O十2e-=2OH-+H2↑ |
| B.在烧杯②中,若铁、铜构成微型电池,则铜为负极 |
| C.在烧杯①中,若构成微型电池,铝为负极 |
| D.在烧杯②中,向溶液中滴加KSCN溶液,溶液一定变为红色 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越
来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为xMg+Mo3S4  MgxMo3S4;在镁原电池放电时,下列说法错误的是
MgxMo3S4;在镁原电池放电时,下列说法错误的是
| A.Mg2+向正极迁移 |
| B.正极反应为:Mo3S4+2xe-=Mo3S42x- |
| C.Mo3S4发生氧化反应 |
| D.负极反应为:xMg-2xe-=xMg2+ |
用铂电极电解某溶液一段时间,该溶液浓度增大而pH减小,该溶液是 ( )
| A.NaOH | B.CuCl2 | C.H2SO4 | D.CuSO4 |
下列叙述不正确的是( )
| A.铁表面镀锌,锌作阳极 |
| B.船底镶嵌锌块,锌作正极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D.工业上电解饱和食盐水的 |
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3-的原理图所示。下列说法不正确的是: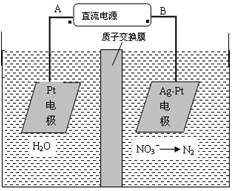
| A.A为电源正极 |
| B.阳极反应式为:2H2O-4e-=4H++O2↑ |
| C.若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为10.4克 |
| D.阴极反应式为:2NO3-+6H2O+10e-=N2↑+12OH- |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )
| A.由TiO2制得1mol 金属Ti ,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为:C + 2O2-? 4e- ="=" CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极(已知铅蓄电池放电时的总反应为Pb + PbO2 + 2H2SO4= 2PbSO4 + 2H2O) |
下列关于原电池的叙述正确的是 ( )
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转化为电能的装置 |
| C.在原电池中,电子流出的一极是负极,该电极被还原 |
| D.原电池放电时,电流的方向是从负极到正极 |