题目内容
下表为元素周期表的一部分,请回答有关问题:
(1)⑤和⑧的元素符号是 和 .
(2)表中最活泼的金属是 ,非金属性最强的元素是 (填元素符号).
(3)工业上冶炼单质④的方法是 ,写出④的氧化物与元素⑥最高价氧化物对应的水化物反应的离子方程式 .
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
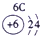
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)表中最活泼的金属是
(3)工业上冶炼单质④的方法是
分析:由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar.根据同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱判断金属性、非金属性最强的元素;工业上电解熔融的氧化铝生成Al,氧化铝与硫酸反应生成硫酸铝与水.
解答:解:由元素在周期表中的位置可知,①为N、②为F、③为Na、④为Al、⑤为Si、⑥为S、⑦为Cl、⑧为Ar,
(1)⑤为Si、⑧为Ar,故答案为:Si;Ar;
(2)根据同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故表中金属性最强为Na,非金属性最强的为F,故答案为:Na;F;
(3)工业上电解熔融的氧化铝生成Al,氧化铝与硫酸反应生成硫酸铝与水,反应离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:电解法;Al2O3+6H+=2Al3++3H2O.
(1)⑤为Si、⑧为Ar,故答案为:Si;Ar;
(2)根据同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故表中金属性最强为Na,非金属性最强的为F,故答案为:Na;F;
(3)工业上电解熔融的氧化铝生成Al,氧化铝与硫酸反应生成硫酸铝与水,反应离子方程式为Al2O3+6H+=2Al3++3H2O,故答案为:电解法;Al2O3+6H+=2Al3++3H2O.
点评:本题考查元素周期表与元素周期律的综合应用,难度不大,侧重学生对基础知识的巩固.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目








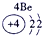
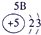
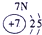
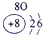
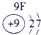
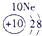
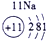





 表示的是
表示的是