题目内容
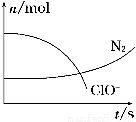
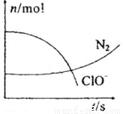
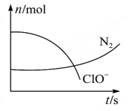
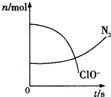 某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )分析:由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价总共升高2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
A、由化合价变化可知氧化产物有HCO3-、N2.
B、所含元素化合价降低的反应物是氧化剂,氧化剂通过还原反应生成的物质是还原产物.结合方程式,利用化合价变化判断.
C、反应中是CN-是还原剂,ClO-是氧化剂,根据化合价升降配平,方程式判断.
D、反应中只有氯元素化合价降低,根据氮气的体积计算参加反应的ClO-的物质的量,反应中Cl元素化合价由+1价降低为-1价,据此计算.
A、由化合价变化可知氧化产物有HCO3-、N2.
B、所含元素化合价降低的反应物是氧化剂,氧化剂通过还原反应生成的物质是还原产物.结合方程式,利用化合价变化判断.
C、反应中是CN-是还原剂,ClO-是氧化剂,根据化合价升降配平,方程式判断.
D、反应中只有氯元素化合价降低,根据氮气的体积计算参加反应的ClO-的物质的量,反应中Cl元素化合价由+1价降低为-1价,据此计算.
解答:解:由曲线变化图可知,随反应进行ClO-的物质的量降低,N2的物质的量增大,故ClO-为反应物,N2是生成物,根据电子转移相等可知,CN-是反应物,由氯元素守恒可知Cl-是生成物,由碳元素守恒可知HCO3-是生成物,由氢元素守恒可知H2O是反应物.反应中Cl元素化合价由+1价降低为-1价,化合价总共降低2价,C元素化合价由+2价升高为+4价,N元素化合价由-3价升高为0价,化合价总共升高2[(4-2)+(3-0)]=10价,故CN-系数为2,ClO-系数为5,由元素守恒可知HCO3-系数为2,N2系数为1,Cl-系数为5,H2O系数为1,反应方程式为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-.
A、反应中,C元素化合价由CN-中+2价升高为HCO3-中+4价,N元素化合价由CN-中-3价升高为N2中0价,可知氧化产物有HCO3-、N2,故A错误;
B、反应中Cl元素化合价由ClO-中+1价降低为Cl-中-1价,ClO-是氧化剂,还原产物是Cl-,故B错误;
C、由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C正确;
D、2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO-的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO-中+1价降低为Cl-中-1价,所以转移电子数为0.5mol×2×NAmol-1=NA,故D错误.
故选:C.
A、反应中,C元素化合价由CN-中+2价升高为HCO3-中+4价,N元素化合价由CN-中-3价升高为N2中0价,可知氧化产物有HCO3-、N2,故A错误;
B、反应中Cl元素化合价由ClO-中+1价降低为Cl-中-1价,ClO-是氧化剂,还原产物是Cl-,故B错误;
C、由上述分析可知,反应为2CN-+5ClO-+H2O=2HCO3-+N2↑+5Cl-,反应中是CN-是还原剂,ClO-是氧化剂,氧化剂与还原剂的化学计量数之比为5:2,故C正确;
D、2.24LN2(标准状况)的物质的量为0.1mol,所以参加反应的ClO-的物质的量为0.5mol,反应中只有氯元素化合价降低,由ClO-中+1价降低为Cl-中-1价,所以转移电子数为0.5mol×2×NAmol-1=NA,故D错误.
故选:C.
点评:考查氧化还原反应计算、基本概念等,难度中等,根据曲线变化图分析反应物、产物,利用守恒生成方程式是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 短周期元素A-F的原子序数依次增大,部分元素的信息如下:
短周期元素A-F的原子序数依次增大,部分元素的信息如下: