题目内容
向少量的氢氧化镁悬浊液中加入饱和的氯化铵溶液,固体会溶解.对此,甲、乙同学分别作了如下解释:
甲:①Mg(OH)2?Mg2++2OH-;②NH4++H2O?NH3?H2O+H+;③H++OH-?H2O.由于③的反应,使平衡①右移,沉淀溶解.
乙:①Mg(OH)2?Mg2++2OH-;②NH4++OH-?NH3?H2O.由于②的反应,使平衡①右移,沉淀溶解.
(1)你认为
(2)为了证明你的结论正确,可向氢氧化镁悬浊液中加入
①硝酸铵溶液;②醋酸铵溶液(呈中性);③盐酸;④醋酸钠溶液;⑤氨水),若出现
甲:①Mg(OH)2?Mg2++2OH-;②NH4++H2O?NH3?H2O+H+;③H++OH-?H2O.由于③的反应,使平衡①右移,沉淀溶解.
乙:①Mg(OH)2?Mg2++2OH-;②NH4++OH-?NH3?H2O.由于②的反应,使平衡①右移,沉淀溶解.
(1)你认为
乙
乙
同学的解释正确.(2)为了证明你的结论正确,可向氢氧化镁悬浊液中加入
②
②
(填序号:①硝酸铵溶液;②醋酸铵溶液(呈中性);③盐酸;④醋酸钠溶液;⑤氨水),若出现
沉淀溶解
沉淀溶解
现象,则证明乙
乙
同学的解释正确.分析:为了证明Mg(OH)2悬浊液与氯化铵溶液的反应原理,可加入醋酸铵溶液检验,因醋酸铵溶液呈中性,如甲同学的解释正确,则氢氧化镁不溶解,如氢氧化镁溶解,则乙同学的解释正确.
解答:解:(1)乙同学的解释正确,故答案为:乙;
(2)将醋酸铵溶液滴入Mg(OH)2的浊液中,甲的解释是铵根离子水解使溶液显酸性,酸性溶液中的H+与氢氧化镁电离的OH-发生中和反应使氢氧化镁溶解,因醋酸铵溶液呈中性,如果氢氧化镁不溶解,则甲同学的解释正确;
乙的解释是只要溶液中存在NH4+,NH4+就与氢氧化镁电离的OH-反应使氢氧化镁溶解,所以加入醋酸铵溶液,如果氢氧化镁溶解,则乙同学的解释正确;
故答案为:②;沉淀溶解;乙.
(2)将醋酸铵溶液滴入Mg(OH)2的浊液中,甲的解释是铵根离子水解使溶液显酸性,酸性溶液中的H+与氢氧化镁电离的OH-发生中和反应使氢氧化镁溶解,因醋酸铵溶液呈中性,如果氢氧化镁不溶解,则甲同学的解释正确;
乙的解释是只要溶液中存在NH4+,NH4+就与氢氧化镁电离的OH-反应使氢氧化镁溶解,所以加入醋酸铵溶液,如果氢氧化镁溶解,则乙同学的解释正确;
故答案为:②;沉淀溶解;乙.
点评:本题考查化学实验方案的设计和评价,涉及盐类水解和弱电解质的电离的探究,侧重于考查学生的实验探究能力和分析能力,题目难度中等.

练习册系列答案
相关题目
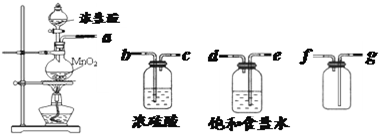

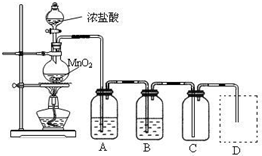
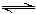 Mg2++2OH-①;
Mg2++2OH-①; +H2O
+H2O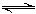
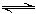 H2O③。由于③的反应,使平衡①右移,沉淀溶解。
H2O③。由于③的反应,使平衡①右移,沉淀溶解。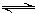 Mg2++2OH-①;
Mg2++2OH-①;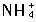 +OH-
+OH-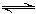 NH3?H2O②。由于②的反应,使平衡①右移,沉淀溶解。
NH3?H2O②。由于②的反应,使平衡①右移,沉淀溶解。